
【题目】18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫 酸100 ml,实验操作如下:
(1)计算并用量筒量取 ml的18.0 mol·L-1的浓硫酸;
(2)将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
(3)将已冷却至室温的硫酸溶液沿玻璃棒注入 ___________;
(4)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(5)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处,改用胶头滴管逐滴加蒸馏水,至液面与刻度线相切
(6)盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签保存。
试分析下列操作对实验结果的影响(偏高、偏低或无影响)
①没有洗涤烧杯和玻璃棒
②定容时俯视读数
③容量瓶使用前有少许水残留
科目:高中化学 来源: 题型:
【题目】下列电离方程式的书写,正确的是
A. NH3·H2O==NH4+ + OH― B. H2SO4==2H+ + SO42―
C. CuCl2== Cu2+ + Cl― D. NaHCO3==Na+ + H+ + CO32―
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为 |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s);△H = -169kJ·mol-1
O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+![]() O2(g)=CO(g);△H = -110.5kJ·mol-1
O2(g)=CO(g);△H = -110.5kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s);△H = -157kJ·mol-1
O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生反应的热化学方程式是:____________。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:

该离子交换膜为__________离子交换膜(填“阴”或“阳”),该电池的阳极反应式为___________,钛极附近的pH值______(填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 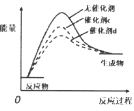 催化剂活性
催化剂活性![]()
B. 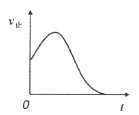
![]()
![]() ,在恒容绝热容器中投入一定量
,在恒容绝热容器中投入一定量![]() 和
和![]() ,正反应速率随时间变化
,正反应速率随时间变化
C. 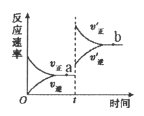
![]()
![]() ,t时刻改变某一条件,则
,t时刻改变某一条件,则![]()
D. 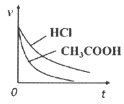 向等体积等pH的HCl和
向等体积等pH的HCl和![]() 中加入等量且足量Zn,反应速率的变化情况
中加入等量且足量Zn,反应速率的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
D. 无论x为何值,两容器中达平衡时w(HI)%均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、![]() 等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示,下列有关说法正确的是( )
等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示,下列有关说法正确的是( )
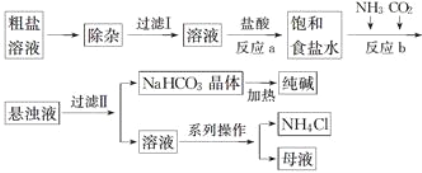
A. 在“侯氏制碱法”中涉及到了氧化还原反应
B. 饱和食盐水中先通入的气体为CO2
C. 流程图中的系列操作中一定需要玻璃棒
D. 工艺中只有碳酸氢钠加热分解产生的CO2可回收循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2—可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
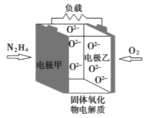
A.电池内的O2—由电极甲移向电极乙
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有1molN2H4消耗时,标况下乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种用离子交换法回收钒的新工艺,回收率达到91.7%。部分含钒物质在水中的溶解性如下表所示:

该工艺的主要流程如图所示:
![]()
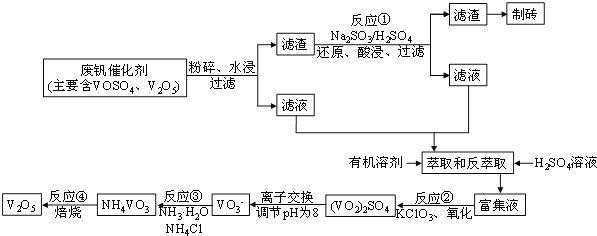
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示____________,用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是________
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为_________________________
(3)若反萃取使用硫酸用量过大,进一步处理会增加_______(填化学式)的用量,造成成本增大。
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O===3(VO2)2SO4+KCl+3H2SO4。若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12︰7,则废钒催化剂中VOSO4 和V2O5的物质的量之比为_____
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式_
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为:_________________
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O![]() V2++VO2++2H+
V2++VO2++2H+
①放电时的正极反应为_______________________
②充电时的阴极反应为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为_______、_________、___________
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有_________、________,将该化合物溶于水,得到常温下pH=a的溶液,此时水电离的c(H+)=________
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是______。此化合物在酸性条件下与高锰酸钾反应的离子方程式为______,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为:_______
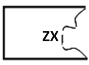
(4)有一瓶固体药品的标签被损坏了,残留部分如图,已知该固体溶于水呈碱性,请推测该固体的化学式可能是(写3种)______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com