
| A. | 在20℃,1.01×105Pa时,22.4L甲烷(CH4)所含的原子数为5NA | |
| B. | 常温常压下,28g氮气所含的原子数为2NA | |
| C. | 标准状况下,22.4L水所含有的分子数目为NA | |
| D. | 0.5mol H2O所含的电子数目为9 NA |
分析 A.20℃不是标准状况,22.4L甲烷的物质的量不是1mol,据此解答即可;
B.28g氮气的物质的量为1mol,据此解答即可;
C.标准状况下,22.4L水的物质的量不是1mol,据此解答即可;
D.水分子中电子数=质子数,据此解答即可.
解答 解:A.20℃不是标准状况,22.4L甲烷的物质的量不是1mol,小于1mol,故22.4L甲烷(CH4)所含的原子数小于5NA,故A错误;
B.28g氮气的物质的量=$\frac{28g}{28g/mol}$=1mol,氮气是双原子分子,故含有原子数为2NA,故B正确;
C.标准状况下,水为液体,不能利用气体摩尔体积计算其物质的量,故C错误;
D.0.5mol水中含有电子的物质的量为0.5mol×(1×2+8)=5mol,故D错误,
故选B.
点评 本题考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


科目:高中化学 来源: 题型:填空题
 如图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知1mol H2(g)、CO(g)和CH3OH(l)的燃烧放出的热量为分别为285.8kJ、283.0kJ和726.5kJ.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知1mol H2(g)、CO(g)和CH3OH(l)的燃烧放出的热量为分别为285.8kJ、283.0kJ和726.5kJ.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氦气含有NA个氦原子 | |
| B. | 20g重水含有10 NA个电子 | |
| C. | 12.5mL l6mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| D. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.016 | B. | 1.00 | C. | 0.986 | D. | 2.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3俗名石灰石,属于碳酸盐 | |
| B. | CaCO3属于含氧酸盐 | |
| C. | 实验室用煅烧CaCO3来制备二氧化碳 | |
| D. | CaCO3 属于难溶性的钙盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 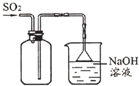 收集SO2 收集SO2 | |
| B. | 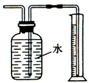 测量Cu与浓硝酸反应生成二氧化氮体积 测量Cu与浓硝酸反应生成二氧化氮体积 | |
| C. | 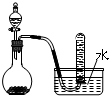 二氧化锰固体和双氧水制取O2 二氧化锰固体和双氧水制取O2 | |
| D. | 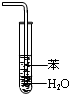 吸收HCl 吸收HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com