
【题目】按要求写出:
(1)溴化钾电子式_____________________。
(2)硫化钠电子式_____________________。
(3)二氧化碳的电子式______________。
(4)铵根离子的电子式_____________。
(5)氮气的电子式______________。
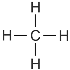
(6)甲烷的结构式____________。
【答案】![]()
![]()
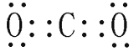
![]()
![]()
【解析】
(1)溴化钾为离子化合物,含有K+和Br-;
(2)硫化钠为离子化合物,含有Na+和S2-;
(3)二氧化碳是共价化合物,C与O之间存在二个共用电子对;
(4)铵根离子的化学式为NH4+;
(5)氮气是双原子分子,两原子之间存在三对共用电子对;
(6)甲烷是正四面体结构。
(1)溴化钾为离子化合物,含有K+和Br-,其电子式为![]() ;
;
(2)硫化钠为离子化合物,含有Na+和S2-,其电子式为![]() ;
;
(3)二氧化碳是共价化合物,C与O之间存在二个共用电子对,其电子式为![]() ;
;
(4)铵根离子的化学式为NH4+,其电子式为![]() ;
;
(5)氮气是双原子分子,两原子之间存在三对共用电子对,其电子式为![]() ;
;
(6)甲烷是正四面体结构,其结构式为 。
。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24L SO3中含有的氧原子数目为0.3NA
B. 18gH218O和2H2O的混合物中,所含中子数为10NA
C. 一定条件下,2.3g的金属钠完全与氧气反应时生成3.6g产物时失去的电子数为0.1NA
D. 物质的量浓度为0.1molL﹣1的MgCl2溶液中,含有Cl﹣个数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列各组物质能一步实现图中所示转化关系的是
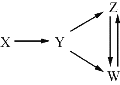
选项 | X | Y | Z | W |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氨气通常有两种方法:
①用固体氢氧化钙与氯化铵共热;
②在常温下用固体氢氧化钠与浓氨水反应。
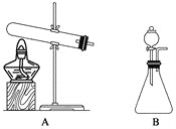
(1)上面的制取装置图中,方法①应选用装置__________(填“A”或“B”,下同);方法②应选用装置__________。
(2)加热氯化铵与氢氧化钙混合物制取氨气的反应方程式是________________。
(3)在制取后,如果要干燥氨气,应选用的干燥剂是________________(填字母)。
A.浓硫酸 B.碱石灰 C.五氧化二磷
(4)检验集气瓶中是否收集满氨气的方法是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是最基本的化学工业之一,其产品用途广泛。
(1)写出氯碱工业电解食盐水的离子方程式____________。
(2)①图1是氯碱工业中阳离子交换膜电解槽示意图(“阳离子交换膜”特性是只允许阳离子通过而阻止阴离子和气体通过)。
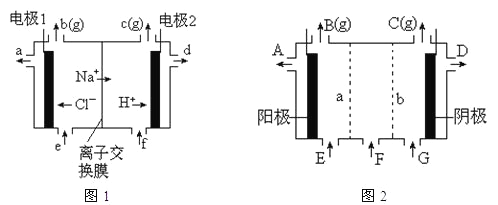
图1中电极1应连接电源的__极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是_____。
②图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。其中a、b处均设有离子交换膜,则a处为__(填“阳”、“阴”)离子交换膜。阳极的电极反应式是___。从D口流出的物质为____。
(3)某同学采用如下装置对氯碱工业中电解食盐水的条件进行探究,记录如下:
装置 | 编号 | 条件控制 | 测定结果 | ||||
电极材料 | 溶液浓度 | 温度/℃ | *电解电压/V | 气体V阴:V阳 | |||
阴极 | 阳极 | ||||||
| I | C | C | 1 mol/L | 25 | 8 | >1:1 |
II | 饱和 | 25 | 5 | ≈1:1 | |||
III | 饱和 | 50 | 4 | ≈1:1 | |||
IV | Fe | C | 饱和 | 50 | 3.5 | ≈1:1 | |
电解电压:开始发生电解反应时的电压
①对比实验I和Ⅱ阴、阳极气体体积比,推测实验I阳极可能有其它气体生成,其它气体的化学式为_____。
②资料显示:“较低的电解电压有利于节能降耗……”。结合上表中Ⅲ和Ⅳ的数据,解释Ⅳ更有利于节能降耗的原因_______________。
(4)资料显示“氯碱工业中采用金属阳极材料,可以降低电解电压,实现节能降耗”,该同学用50℃的饱和NaCl溶液进行实验验证,结果如下:
装置 | 编号 | 电极材料 | 电解 电压/V | 现象 | |
阴极 | 阳极 | ||||
| V | Fe | Fe | 1.5 | 阴极:产生无色气体 U形管底部:有白色沉淀生成 |
VI | Fe | Cu | 2 | 阴极:产生无色气体 阳极:有白色胶状沉淀生成且逐渐增多 U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色,最后变成砖红色 | |
实验V中,通过检验阴、阳极附近溶液所含离子,推断产生白色沉淀为Fe(OH)2 。该同学经查阅资料分析认为:“实验VI中白色沉淀是CuCl,淡黄色沉淀是CuOH。
i.阳极生成CuCl的电极反应式为_________。
ii.用化学用语和必要文字解释阴极区白色胶状沉淀转化为淡黄色的原因___________。
该同学通过以上探究认为,氯碱工业中不能采用Fe、Cu作阳极材料。
(5)综合以上探究,你对氯碱工业中电解食盐水条件控制的建议有 _____(至少写出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烃①C4H8 ②C4H10 ③C6H12 ④C7H8分别完全燃烧,耗氧量分析正确的是
A. 等质量时耗氧量最多的是④
B. 等物质的量时耗氧量最少的是②
C. 等物质的量时③和④耗氧量相等
D. 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减小,则y>4;反之,则y<4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是一种高效绿色氧化剂,可用于废水和生活用水的处理。从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2H2O+2OH![]() FeO42-+3H2↑,工作原理如图所示。己知:Na2FeO4只在强碱性条件下稳定,易被H2还原。下列说法正确的是
FeO42-+3H2↑,工作原理如图所示。己知:Na2FeO4只在强碱性条件下稳定,易被H2还原。下列说法正确的是
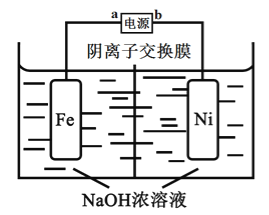
A. b是电源的正极
B. 阳极电极反应为Fe-6e-+4H2O= FeO42-+ 8H+
C. 电解过程中,需要将阴极产生的气体及时排出
D. 当电路中通过1mol电子的电量时,会有11.2L的H2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com