
| A. | 将过量的氯气通入碘化亚铁溶液:3Cl2+2Fe2++4I-═6Cl-+2Fe3++2I2 | |
| B. | 硫酸在加热条件下将铜氧化:Cu+2H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2↑ | |
| C. | 在氢氧化钡溶液中加入过量的硫酸氢铵:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3↑+2H2O | |
| D. | 将金属钠投入水中:2Na+2H+═2Na++H2↑ |
分析 A.氯气过量,碘离子和亚铁离子都被氯气氧化;
B.与铜反应的硫酸必须为浓硫酸,且反应不会生成氢气;
C.硫酸氢铵过量,氢离子优先与氢氧根离子反应,铵根离子不反应;
D.钠与水反应生成氢氧化钠和氢气,水不能拆开.
解答 解:A.将过量的氯气通入碘化亚铁溶液,反应生成氯化铁和碘单质,反应的离子方程式为:3Cl2+2Fe2++4I-═6Cl-+2Fe3++2I2,故A正确;
B.铜不与稀硫酸反应,铜与浓硫酸共热能够生成硫酸铜、二氧化硫气体和水,正确的离子方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO42-+SO2↑+2H2O,故B错误;
C.在氢氧化钡溶液中加入过量的硫酸氢铵,铵根离子不参与反应,正确的离子方程式为:2OH-+2H++Ba2++SO42-═BaSO4↓+2H2O,故C错误;
D.金属钠投入水中生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2OH-+2Na++H2↑,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 三者对应的氧化物均为酸性氧化物 | |
| B. | 三者的单质直接与氧气反应都能生成两种及以上氧化物 | |
| C. | 三者对应氢化物的水溶液可能呈中性、碱性、酸性 | |
| D. | C02、N02、S02都能与H20反应,其反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | 只有⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “氯碱法”的副产品为氢气 | B. | “铝热法”常用于冶炼铁 | ||
| C. | “空气吹出法”用于海水中提取碘 | D. | “侯氏制碱法”制得的是火碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
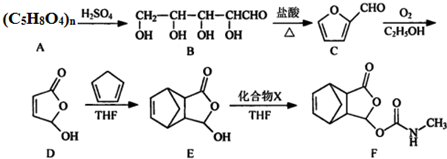
 .
.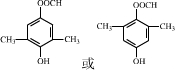 .
.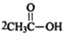 $\stackrel{P_{2}O_{3}}{→}$
$\stackrel{P_{2}O_{3}}{→}$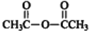 ,化合物
,化合物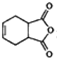 是合成抗病毒药阿普洛韦的中间体,请设计合理方案以
是合成抗病毒药阿普洛韦的中间体,请设计合理方案以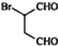 和
和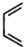 为原料合成该化合物(用合成路线流程图表示:并注明反应条件).合成路线流程图实力如下CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
为原料合成该化合物(用合成路线流程图表示:并注明反应条件).合成路线流程图实力如下CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳的电子式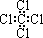 | B. | 环丙烷的最简式CH2 | ||
| C. | 甲醛的结构式HCHO | D. | S2-的最外层电子排布式3s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
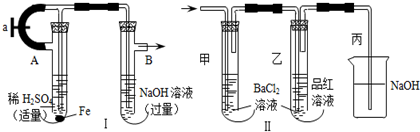
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com