
25 ”ꏱ,ijĖįŠŌČÜŅŗÖŠÖ»ÓŠNa£«”¢CH3COO£”¢H£«”¢OH£ĖÄÖÖĄė×Ó”£ŌņĻĀĮŠĆčŹöÕżČ·µÄŹĒ
A£® ¼ÓČėŹŹĮæ°±Ė®£¬c(CH3COO£)Ņ»¶Ø“óÓŚc(Na£«)”¢c(NH )Ö®ŗĶ
)Ö®ŗĶ
B£®øĆČÜŅŗÓɵČĪļÖŹµÄĮæÅØ¶Č”¢µČĢå»żµÄNaOHČÜŅŗŗĶCH3COOHČÜŅŗ»ģŗĻ¶ų³É
C£®¼ÓČėŹŹĮæNaOH£¬ČÜŅŗÖŠĄė×ÓÅضČĪŖc(CH3COO£)>c(Na£«)>c(OH£)>c(H£«)
D£®øĆČÜŅŗÓÉpH£½3µÄCH3COOHÓėpH£½11µÄNaOHČÜŅŗµČĢå»ż»ģŗĻ¶ų³É
 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””””””””£©
£Į£®Õō·¢ŹĒĪŖĮĖ³żČ„ČܼĮµĆµ½¾§Ģ壬ÕōĮóŹĒĪŖĮĖµĆµ½ŅŗĢå³É·Ö
£Ā£®½šŹōŃõ»ÆĪļŅ»¶ØŹĒ¼īŠŌŃõ»ÆĪļ £Ć£®ĖįŠŌŃõ»ÆĪļŅ»¶ØŹĒ·Ē½šŹōŃõ»ÆĪļ
£Ä£®ĪļÖŹµÄĮæŹĒĘßøö»ł±¾ĪļĄķĮæÖ®Ņ»£¬ŹĒÓĆÓŚĆčŹöŅ»¶ØĮ£×ÓŹżÄæµÄĪļĄķĮæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĄė×Ó×éÖŠĖłøųĄė×ÓŌŚĖ®ČÜŅŗÖŠÄÜ“óĮæ¹²“ę£¬ĒŅµ±¼ÓČėŹŌ¼Įŗó·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹéŠ“ĶźČ«ĒŅÕżČ·µÄŹĒ (””””)
| Ń”Ļī | Ąė×Ó×é | ¼ÓČėŹŌ¼Į | ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ |
| A | Fe3+”¢S2”„”¢Cl”„”¢Na+ | NaOHČÜŅŗ | Fe3£«+3OH”„=Fe(OH)3”ż |
| B | Na+”¢Al3+”¢Cl”„”¢SO42”„ | ÉŁĮæKOHČÜŅŗ | Al3++3OH”„=Al(OH)3”ż |
| C | H+”¢Fe2£«”¢SO42”„”¢NO3”„ | BaCl 2ČÜŅŗ | SO42”„+Ba2£«=BaSO4”ż |
| D | Na+”¢K+”¢ClO”„”¢ SO42”„ | ĶØČėÉŁĮæSO2 | 2ClO”„+SO2+H2O=2HClO+SO32”„ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚÕō·¢ĆóÖŠ¼ÓČČÕōøÉĻĀĮŠĪļÖŹµÄĖ®ČÜŅŗ²¢×ĘÉÕ(µĶÓŚ400”ę)£¬æÉŅŌµĆµ½øĆĪļÖŹµÄ¹ĢĢåµÄŹĒ
A£®ĀČ»ÆĀĮ B£®Ģ¼ĖįĒāÄĘ C£®ĮņĖįĆ¾ D£®øßĆĢĖį¼Ų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖŅŅĖį(HA)µÄĖįŠŌ±Č¼×Ėį(HB)Čõ£¬ŌŚĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0.1 mol”¤L£1µÄNaAŗĶNaB»ģŗĻČÜŅŗÖŠ£¬ĻĀĮŠÅÅŠņÕżČ·µÄŹĒ
A£®c(OH£)>c(HA)>c(HB)>c(H£«) B£®c(OH£)>c(A£)>c(B£)>c(H£«)
C£®c(OH£)>c(B£)>c(A£)>c(H£«) D£®c(OH£)>c(HB)>c(HA)>c(H£«)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¹¤ŅµÖʱøĀČ»ÆĶŹ±£¬½«ÅØŃĪĖįÓĆÕōĘų¼ÓČȵ½80”ę×óÓŅ£¬ĀżĀż¼ÓČė“ÖCuO·ŪÄ©(ŗ¬ŌÓÖŹFe2O3”¢FeO)£¬³ä·Ö½Į°čŹ¹Ö®Čܽā£¬µĆŅ»ĒæĖįŠŌµÄ»ģŗĻČÜŅŗ£¬ĻÖÓū“ÓøĆ»ģŗĻČÜŅŗÖŠÖʱø“æ¾»µÄCuCl2ČÜŅŗ[²Īæ¼Źż¾Ż£ŗpH”Ż9.6Ź±£¬Fe2£«ĶźČ«Ė®½ā³ÉFe(OH)2£»pH”Ż6.4Ź±£¬Cu2£«ĶźČ«Ė®½ā³ÉCu(OH)2£»pH”Ż3.7Ź±£¬Fe3£«ĶźČ«Ė®½ā³ÉFe(OH)3]”£Ēė»Ų“šŅŌĻĀĪŹĢā£ŗ
(1)µŚŅ»²½³żFe2£«£¬ÄÜ·ńÖ±½Óµ÷ÕūpH£½9.6½«Fe2£«³Įµķ³żČ„£æ______£¬ĄķÓÉŹĒ______
_____________________________________________________________________ӣ
ÓŠČĖÓĆĒæŃõ»Æ¼ĮNaClO½«Fe2£«Ńõ»ÆĪŖFe3£«£ŗ
¢Ł¼ÓČėNaClOŗó£¬ČÜŅŗµÄpH±ä»ÆŹĒ___________£ØĢīŠņŗÅ£©£»
A£®Ņ»¶ØŌö“ó B£®Ņ»¶Ø¼õŠ”
C£®æÉÄÜŌö“ó D£®æÉÄܼõŠ”
¢ŚÄćČĻĪŖÓĆNaClO×÷Ńõ»Æ¼ĮŹĒ·ńĶ×µ±£æ__________£¬ĄķÓÉŹĒ_________________
___________________________________________________________ӣ
¢ŪĻÖÓŠĻĀĮŠ¼øÖÖ³£ÓƵÄŃõ»Æ¼Į£¬æÉÓĆÓŚ³żČ„øĆ»ģŗĻČÜŅŗÖŠFe2£«µÄÓŠ_________£ØĢīŠņŗÅ£©”£
A£®ÅØHNO3 B£®KMnO4 C£®Cl2 D£®O2
(2)³żČ„ČÜŅŗÖŠµÄFe3£«µÄ·½·ØŹĒµ÷ÕūČÜŅŗµÄpH£½3.7£¬ĻÖÓŠĻĀĮŠŹŌ¼Į¾łæÉŅŌŹ¹ĒæĖįŠŌČÜŅŗµÄpHµ÷Õūµ½3.7£¬æÉŃ”ÓƵÄÓŠ__________£ØĢīŠņŗÅ£©”£
A£®NaOH”” B£®°±Ė®”” C£®Cu2(OH)2CO3 D£®Na2CO3””
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ
A£®µČĪļÖŹµÄĮæµÄNH4HCO3ÓėBa(OH)2ČÜŅŗ»ģŗĻŗó¼ÓČČ£ŗNH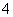 £«OH£
£«OH£NH3”ü£«H2O
B£®ĖįŠŌµÄµķ·Ūµā»Æ¼ŲČÜŅŗŌŚæÕĘųÖŠ±äĄ¶£ŗ4I££«O2 £«4H+= 2H2O £«2I2
C£®1molCl2ĶØČėŗ¬1mol FeI2µÄČÜŅŗÖŠ£ŗ2Fe2£«£«2I££«2Cl2£½2Fe3£«£«4Cl££«I2
D£®¹żĮæSO2ĶØČėBa(NO3)2ČÜŅŗÖŠ£ŗ3SO2+2NO3-+3Ba2++2H2O£½3BaSO4”ż+2NO”ü+4H+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ (””””)
A£®Ź³ŃĪČÜŅŗÖŠ³żČ„SO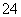 ×īŗĻŹŹµÄŹŌ¼ĮŹĒBa(NO3)2
×īŗĻŹŹµÄŹŌ¼ĮŹĒBa(NO3)2
B£®NaClČÜŅŗŗĶCH3COONH4ČÜŅŗ¾łĻŌÖŠŠŌ£¬Į½ČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶ČĻąĶ¬
C£®25 ”ꏱ,ÓĆ“×ĖįČÜŅŗÖŠŗĶµČÅضČNaOHČÜŅŗÖĮpH£½7£¬VCH3COOH£¼VNaOH
D£®AgClŅ××Ŗ»ÆĪŖAgI³ĮµķĒŅKsp(AgX)£½[Ag£«]·[X£]£¬¹ŹKsp(AgI)£¼Ksp(AgCl)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖNH3”¤H2O£Øaq£©ÓėH2SO4£Øaq£©·“Ӧɜ³É1molÕżŃĪµÄ·“Ó¦ČČ
”÷H= -24.2kJ/moL£»Ļ”ŃĪĖįÓėĻ”ĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦µÄÖŠŗĶČČ”÷H= -57£®3kJ/mol”£
ŌņNH3•H2OŌŚĖ®ČÜŅŗÖŠµēĄėµÄ”÷HµČÓŚ
A£®-69.4kJ/mol B£®-45.2 kJ/mol C£®+69.4kJ/mol D£®+45.2 kJ/mol
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com