
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
科目:高中化学 来源: 题型:
有4种混合溶液,分别由等体积0.1 mol/L的2种溶液混合而成:
①CH3COONa与Na2CO3;②CH3COONa与NaCl;
③CH3COONa与NaOH;④CH3COONa与HCl。
c(CH3COO-)排序正确的是( )
A.③>①>②>④ B.③>②>①>④
C.④>②>①>③ D.④>②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验设计能够达到目的的是
| 编号 | 实验目的 | 实验设计 |
| A | 证明盐酸酸性比醋酸强 | 用同一电路测等体积盐酸、醋酸溶液的导电性 |
| B | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
| C | 证明钠的金属活动性比铜强 | 向CuCl2溶液中投入金属钠 |
| D | 证明溶液中含有I- | 向溶液中加入淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化镁在医药、建筑等行业应用广泛。硫酸 镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
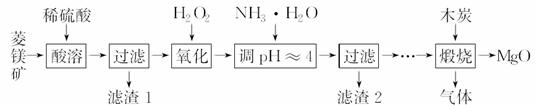
(1)MgCO3与稀硫酸反应的离子方程式为__________________________________。
(2)加入H2O2氧化时,发生反应的化学方程式为____________________________。
(3)滤渣2的成分是________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C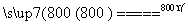 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体可以是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.Na2CO3溶液
c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI>Ag2CrO4
B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI
D.Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作内服造影剂,这种检查手段称为钡餐透视。
(1)医学上进行钡餐透视时为什么不用BaCO3?(用离子方程式表示)________________________________________________________________________。
(2)某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:
a.5 mL 水;
b.40 mL 0.2 mol/L 的Ba(OH)2溶液;
c.20 mL 0.5 mol/L的Na2SO4 溶液;
d.40 mL 0.1 mol/L 的H2SO4 溶液中,溶解至饱和。
①以上各溶液中,Ba2+的浓度由大到小的顺序为________。
A.b>a>c>d B.b>a>d>c
C.a>d>c>b D.a>b>d>c
②已知298 K时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液b中的SO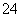 浓度为________ mol/L,溶液c中Ba2+的浓度为________ mol/L。
浓度为________ mol/L,溶液c中Ba2+的浓度为________ mol/L。
③某同学取同样体积的溶液b和溶液d直接混合,则混合液的pH为________(设混合溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。
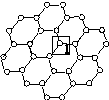

(a)石墨烯结构 (b)氧化石墨烯结构
(1)图(a)中,1号C与相邻C形成σ键的个数为________。
(2)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
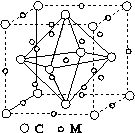
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R五种分属于不同主族的短周期元素,原子序数依次增大,X的气态氢化物分子中只有一对孤电子对;Y、Z、W的最高价氧化物对应的水化物可以两两相互反应。
(1)X在周期表中的位置是________;Z3+的核外电子排布式为________。
(2)Y、Z、R的第一电离能的大小顺序为________(用元素符号表示)。
(3)W的最高正价氧化物的分子构型为________;将该氧化物溶于水,则所得溶液中阴离子中的W杂化轨道类型为________。
(4)将R的单质与Y的最高价氧化物对应的水化物混合,其反应的离子方程式为________________________________________________________________________。
(5)图K332所示为Y、Z形成的合金晶胞结构,如果将含1 mol Y的该合金置于足量的水中充分反应,放出标准状况下气体的体积为________L。

图K332
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中属于纯净物的是
①由同种元素组成的物质 ②具有固定熔沸点的物质 ③由相同种类和相同数目的原子组成的分子 ④只有一种元素的阳离子和另一种元素的阴离子组成的物质 ⑤在氧气中燃烧只生成二氧化碳的物质 ⑥只含有一种分子的物质
A.②③⑥ B.④⑤⑥
C.①④ D.②⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com