
【题目】a g Mg、Al合金完全溶解在C1 mol·L-1、V1L HCl溶液中,产生bmolH2。再向反应后的溶液中加入C2 mol·L-1、V2 L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g。下列关系错误的是( )
A.![]() B.C1=C2V2/V1
B.C1=C2V2/V1
C.铝为 (12b-a)/9 mol D.与金属反应后剩余盐酸为![]() mol
mol
【答案】D
【解析】
试题解析: 设合金中含有xmolMg,ymolAl,反应的化学方程式分别为:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,产生b g H2,则有①24x+27y=a ; ②x+1.5y=b/2; ,解之得y=(12b-a)/9; x=(a-9b)/6 ,再向反应后的溶液中加入C2molL-1、V2L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g,根据Mg~H2~Mg(OH)2,Al~1.5H2~Al(OH)3,反应生成沉淀的质量等于金属的质量加氢氧根离子的质量,而氢氧根离子的物质的量等于2n(H2),则d=a+17b,反应后溶液的成分为NaCl,则C1×V1=C2×V2,即C1=C2V2/V1; 生成bgH2,则消耗盐酸b/2×2==bmol;反应后剩余盐酸的物质的量为(C1V1-b)mol,显然只有D符合题意;
考点:有关镁铝与酸反应,镁铝的盐溶液与碱反应的计算;


科目:高中化学 来源: 题型:
【题目】下列有关物质性质的说法正确的是( )
A.热稳定性:HCl<HBr<HI
B.原子半径:K<Na<Li
C.熔点:Cl2>Br2>I2
D.氧化性:Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在城市地下常埋有纵横交错的管道和运输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起金属管道、铁轨的腐蚀。原理简化如图所示。则下列有关说法不正确的是
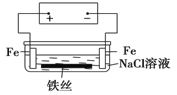
A.原理图可理解为两个串联电解装置
B.如在NaCl溶液中加入酚酞,右边Fe电极附件溶液变红
C.地下管线被腐蚀,不易发现,也不便维修,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等)
D.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质应用的叙述中,正确的是
A. SiO2用于半导体材料 B. 明矾可以用于自来水的杀菌消毒
C. 过氧化钠可用作潜艇供氧剂 D. 工业上采用电解饱和NaCl溶液制取Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿佛加德罗常数,下列说法正确的是( )
A.标准状况下,2.24L水的质量为1.8g
B.常温常压下,32gO3含有的原子数为2NA
C.11.2L的N2含有的质子数为7NA
D.0.1molNa投入到5mL水中转移电子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如图所示:
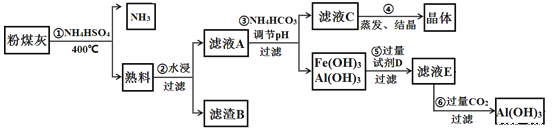
回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式_____________。在NH4Al(SO4)2溶液中加入Ba(OH)2溶液使硫酸根离子恰好完全沉淀,写出反应的离子方程式:____________。
(2)滤渣B的主要成分为_____________。
(3) 已知Ksp[Fe(OH)3]=4×10-38,Ksp [Al(OH)3]=1×10-33。为实现步骤③的实验目的,应使溶液中c(Fe3+)、c(Al3+)均小于或等于1×10-9 molL﹣1可认为完全沉淀,则溶液A至少应调节到pH=_____________。用NH4HCO3调节pH的实验原理为_____________(用离子方程式表示)。
(4)实验室进行第④步操作时,所需的仪器是酒精灯、石棉网、三脚架、__________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A. 同素异形体 B. 同分异构体 C. 同系物 D. 同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com