
| A. | ${\;}_{53}^{131}$I的原子核外电子数为53 | |
| B. | ${\;}_{53}^{131}$I与${\;}_{53}^{127}$I互为同位素 | |
| C. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| D. | ${\;}_{53}^{131}$I与${\;}_{53}^{127}$I为同种核素 |
分析 53131I是一种原子,其质量数为131,质子数为53,中子数=质量数-质子数,质子数=核外电子数,质子数相同,中子数不同的原子互为同位素.
解答 解:A、53131I的质子数为53,则电子数为53,故A正确;
B、${\;}_{53}^{131}$I与${\;}_{53}^{127}$I,质子数相同,中子数不同,互为同位素,故B正确;
C、同种元素的原子的化学性质相同,故C正确;
D、${\;}_{53}^{131}$I与${\;}_{53}^{127}$I质子数相同,中子数不同,互为同位素,是不同的核素,故D错误;
故选:D.
点评 本题主要考查核素、元素、同位素的关系,明确原子符号中的数字的意义及原子中量的关系即可解答,题目难度不大.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ①中的物质 | ②中的物质 | ③中的物质 | ③中的现象 | 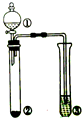 |
| A | 浓氨水 | NaOH | AlCl3溶液 | 先产生白色沉淀,后沉淀溶解 | |
| B | 浓盐酸 | MnO2 | KI溶液 | 溶液变蓝色 | |
| C | 浓硫酸 | Na2SO3 | Ba(NO3)2溶液 | 无沉淀生成 | |
| D | 浓硝酸 | Cu | 含酚酞的NaOH溶液 | 溶液红色褪去 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有2NA个氦原子的氦气在标准状况下的体积约为22.4L | |
| B. | 25℃,1.01×105 Pa,64g SO2中含有的O原子数为2NA | |
| C. | 在常温常压下,22.4L Cl2含有的分子数为NA | |
| D. | 标准状况下,11.2LCH3CH2OH(酒精)含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 控制高能耗企业上马 | |
| B. | 加大对污染企业的整治力度 | |
| C. | 无节制地开采煤、石油、天然气等矿物资源 | |
| D. | 倡导“绿色化学”理念,逐步实现化工企业零排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
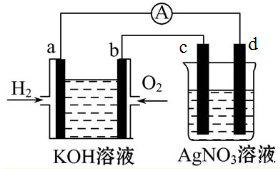
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com