
常温下测得某无色溶液中水电离出c(H+)=1×10-11mol/L,又知该溶液中还有大量NO3-、NH4+、Cl-,那么该溶液中还一定大量存在的离子是( )
A.[Al(OH)4]-、ClO- B.Mg2+、SO42-
C.Cu2+、HCO3- D.Ba2+、I-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在一定条件下A与B反应可生成C和D,其能量变化如图:

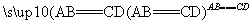

下列有关反应A+B===C+D的说法正确的是 ( )。
A.反应前后原子的种类和数目一定不变
B.反应前后分子的种类和数目一定改变
C.反应物的总能量E1与生成物的总能量E2一定相等
D.此反应一定有热量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与环境、材料、信息、能源关系密切,下列说法正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
C.PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
D.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶
液混合反应制备ClO2气体,再用水吸收该气体可得
ClO2溶液。在此过程中需要控制适宜的温度,若温
度不当,副反应增加,影响生成ClO2气体的纯度,
且会影响ClO2的吸收率,具体情况如图所示。
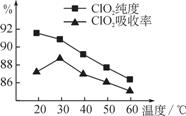
(1)据图可知,反应时需要控制的适宜温度是________℃,
要达到此要求需要采取的措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下可被ClO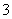 氧化成SO
氧化成SO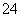 ,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式: 。
,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式: 。
(3)该小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品
6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.0500 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:
4H++ClO2+5Fe2+===Cl-+5Fe3++2H2O
14H++Cr2O +6Fe2+===2Cr3++6Fe3++7H2O
+6Fe2+===2Cr3++6Fe3++7H2O
试计算ClO2的“产率” (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应:3H2+N2 2NH3其反应速率可以分别用v(H2)、v(N2)、v(NH3)[单位均为mol/(L·s)]表示,则正确的关系是
 ( )
( )
A.v(H2)=v(N2)=v(NH3)
B.v(N2)=2v(NH3)
C.v(H2)=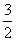 v(NH3)
v(NH3)
D.v(N2)=3v(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应,X(g)+Y(g) 2Z(g)+W(g);ΔH<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是( )
2Z(g)+W(g);ΔH<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是( )
A.反应速率:v(B)>v(A) B.A容器中X的转化率为80%
C.平衡时Y体积分数:A<B D.打开活塞K重新达平衡VA=2.2aL

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-―→2O2-)。
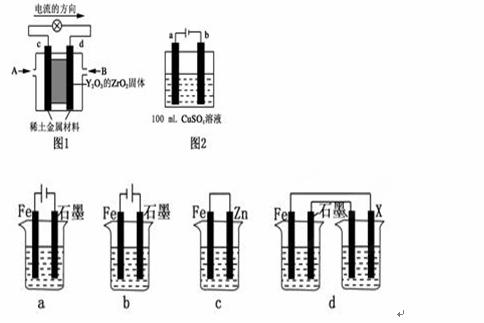
(1) ①c电极的名称为________,d电极上的电极反应式为 。
②如图2所示电解100mL 0.5mol·L-1 CuSO4溶液。若a电极产生56mL(标准状况)气体,则所得溶液的pH=_____(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入______(填字母序号)。a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2 (OH)2CO3
(OH)2CO3
(2)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是________ (填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
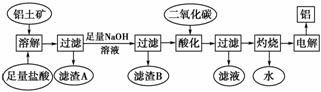
已知: 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;回答下列问题:
(1)向铝土矿中加入足量盐酸过滤后所得滤渣A的主要成分为________。
(2)在工艺流程中,加入足量氢氧化钠溶液过程中发生反应的离子方程式为__________________________________________________________________________,
过滤后所得滤渣B的成分为________。用二氧化碳酸化后过滤所得滤液中的溶质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。

请回答下列问题:
(1)A中加入的物质是________,发生反应的化学方程式是________________________________________________________________________。
(2)B中加入的物质是________,其作用是________________________________________________________________________________________________________________________________________________。
(3)实验时在C中观察到的现象是________________________________________________________________________,
发生反应的化学方程式是________________________________________________________________________。
(4)实验时在D中观察到的现象是________________________________________________________________________,
D中收集到的物质是_______,检验该物质的方法和现象是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com