
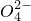 )≤1.0×10-5 mol?L-1,应保持溶液中c(Ba2+ )≥______mol?L-1.
)≤1.0×10-5 mol?L-1,应保持溶液中c(Ba2+ )≥______mol?L-1. ,当c(SO42-)≤1.0×10-5 mol?L-1,所以溶液中c(Ba2+ )≥1.1×10-5mol/L,故答案为:1.1×10-5;
,当c(SO42-)≤1.0×10-5 mol?L-1,所以溶液中c(Ba2+ )≥1.1×10-5mol/L,故答案为:1.1×10-5; =0.002mol,取25.00mL溶液A,滴加适量稀硫酸,用0.020 0mol?L-1 KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00mL,所以亚铁离子的物质的量为:5×0.02-1×10×10-3=1×10-3mol,铵根离子的物质的量为:2×2.0×10-3-2×1.0×10-3=2×10-3(mol),根据质量守恒,水的物质的量:[1.5680g×
=0.002mol,取25.00mL溶液A,滴加适量稀硫酸,用0.020 0mol?L-1 KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00mL,所以亚铁离子的物质的量为:5×0.02-1×10×10-3=1×10-3mol,铵根离子的物质的量为:2×2.0×10-3-2×1.0×10-3=2×10-3(mol),根据质量守恒,水的物质的量:[1.5680g× -1.0×10-3-3mol×152g/mol-1.0×10-3×132g/mol]×
-1.0×10-3-3mol×152g/mol-1.0×10-3×132g/mol]×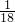 =6.0×10-3,所以x:y:z=1:1:6,化学式为:FeSO4?(NH4)2SO4?6H2O.
=6.0×10-3,所以x:y:z=1:1:6,化学式为:FeSO4?(NH4)2SO4?6H2O.

科目:高中化学 来源: 题型:
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏州市高三调研测试化学试卷(解析版) 题型:计算题
摩尔盐[xFeSO4·y(NH4)2SO4·zH2O]是一种重要化工原料。其组成可通过下列实验测定:
①称取1.5680 g 样品,准确配成100 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g。
③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0200 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1. 0×10-5mol·L-1,应保持溶液中c(Ba2+)
≥ mol·L-1。
(2)③中发生反应的离子方程式为 ,滴定终点的现象是 。
(3)通过计算确定样品的组成(必须写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com