
| A. | 1-丙醇与浓氢溴酸反应:CH3CH2 CH2OH+HBr$\stackrel{△}{→}$CH3CH2 CH2Br+H2O | |
| B. | 1-溴丙烷与氢氧化钠溶液共热:CH3CH2 CH2Br+NaOH$→_{△}^{水}$CH3CH2 CH2OH+NaBr | |
| C. | 苯酚钠中通入少量二氧化碳:2 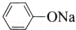 +CO2+H2O→2 +CO2+H2O→2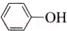 +Na2CO3 +Na2CO3 | |
| D. | 蔗糖在稀硫酸作用下水解:C12H22O11(蔗糖)+H2O$→_{△}^{稀硫酸}$C6H12O6(果糖)+C6H12O6(葡萄糖) |
分析 A.二者发生取代反应生成1-溴丙烷和水;
B.1-溴丙烷与氢氧化钠溶液共热,发生取代反应生成乙醇和溴化钠;
C.苯酚的酸性大于碳酸氢根离子,反应生成苯酚和碳酸氢钠;
D.蔗糖在稀硫酸存在条件下加热水解生成葡萄糖和果糖.
解答 解:A.1-丙醇与浓氢溴酸发生取代反应,反应的化学方程式为:CH3CH2 CH2OH+HBr$\stackrel{△}{→}$CH3CH2 CH2Br+H2O,故A正确;
B.1-溴丙烷与氢氧化钠溶液共热发生水解反应,反应的化学方程式为:CH3CH2 CH2Br+NaOH$→_{△}^{水}$CH3CH2 CH2OH+NaBr,故B正确;
C.苯酚钠中通入少量二氧化碳,反应生成苯酚和碳酸氢钠,正确的化学方程式为:2 +CO2+H2O→
+CO2+H2O→ +NaHCO3,故C错误;
+NaHCO3,故C错误;
D.蔗糖在稀硫酸作用下水解生成葡萄糖和果糖,反应的化学方程式为:C12H22O11(蔗糖)+H2O$→_{△}^{稀硫酸}$C6H12O6(果糖)+C6H12O6(葡萄糖),故D正确;
故选C.
点评 本题考查了化学方程式的书写方法,题目难度不大,侧重考查有机物结构与性质,明确常见有机物含有官能团与具有性质之间的关系为解答关键,试题有利于提高学生的灵活应用能力.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
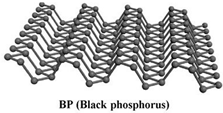 最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )| A. | 黑磷导电属于化学变化 | B. | 黑磷属于高分子化合物 | ||
| C. | 黑磷与白磷互为同素异形体 | D. | 黑磷高温下在空气中可以稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
. $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
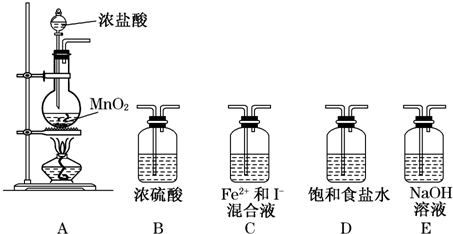
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分别置于A、B两试管中:往A中滴加KSCN溶液;往B中滴加淀粉溶液 | ①A中溶液变红,B中溶液不变蓝, 则假设1成立. ②A中溶液不变红,B中溶液变蓝, 则假设2成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入稀盐酸无明显现象,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| CaS04 | Mg2(OH)2C03 | CaC03 | BaS04 | BaC03 |
| 2.6×1 0-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×1 0-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com