
| A. | 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+)═10-7mol•L-l | |
| B. | 常温下pH=2的盐酸和pH=12的氨水等体积混合后c(C1-)+c(H+)═c(NH4+)+c(OH-) | |
| C. | 常温下0.1 mol•L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)=10 -10 mol•L-l | |
| D. | 常温下向10 mL0.1 mol•L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$将减小 |
分析 A.同浓度的强酸、强碱不一定都是一元酸和碱,混合后溶液可能显酸性或碱性;
B.常温下pH=2的盐酸和pH=12的氨水等体积混合,溶液显碱性,结合电荷守恒分析;
C.常温下0.1 mol•L-1的Na2A溶液的pH=10溶液显碱性,为强碱弱酸盐,溶液中氢氧根离子是水完全电离出的离子;
D.常温下向10 mL0.1 mol•L-1的CH3 COOH溶液中滴加相同浓度的氨水,反应生成醋酸氨,溶液中氢离子浓度减小,结合离子积常数和平衡常数分析判断.
解答 解:A.常温下同浓度的强酸、强碱等体积混合后,酸碱的元数不确定溶液不一定显中性,由水电离出的c(H+)不一定为10-7mol•L-l ,故A错误;
B.一水合氨为弱碱,存在电离平衡,常温下pH=2的盐酸和pH=12的氨水等体积混合,溶液显碱性,溶液中存在电荷守恒c(C1-)+c(OH-)═c(NH4+)+c(H+),c(OH-)>c(H+),c(C1-)<c(NH4+),若混合后c(C1-)+c(H+)═c(NH4+)+c(OH-),c(C1-)>c(NH4+),故B错误;
C.常温下0.1 mol•L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)=10 -4 mol•L-l,故C错误;
D.溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{Kb}{c(O{H}^{-})}$,常温下向10 mL0.1 mol•L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,反应生成醋酸氨,溶液中氢离子浓度减小,氢氧根离子浓度增大,Kb不变,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值减小,故D正确;
故选D.
点评 本题考查了弱电解质电离平衡影响因素、酸碱反应后溶液酸碱性判断、电解质溶液中电荷守恒、盐类水解等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 天平所配的砖码有脏污 | |
| B. | 药品保存不善,露置时间过长 | |
| C. | 定容时液面与容量瓶壁交界处到达刻度就定容完毕 | |
| D. | 溶解步骤完成后,洗涤次数过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),同时利用此装置的电能在铁上镀铜,下列说法错误的是( )
),同时利用此装置的电能在铁上镀铜,下列说法错误的是( )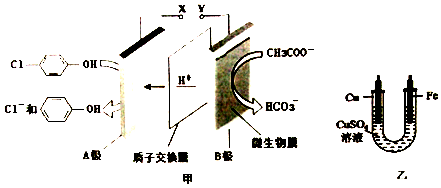
| A. | 铁电极应与Y相连接 | |
| B. | 反应过程中甲中右边区域溶液pH逐渐升高 | |
| C. | A极的电极反应式为 +2e-+H+=Cl-+ +2e-+H+=Cl-+ | |
| D. | 当外电路中有0.2 mole-转移时,A极区增加的H+的个数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,44.8L NO与22.4L O2反应后的分子数是2NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与6.5g锌共热,转移的电子数等于0.2NA | |
| C. | 常温常压下,1.8g甲基(-CD3)中含有的中子数为NA | |
| D. | 0.5mol苯乙烯( 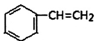 )中含有碳碳双键的数目为2NA )中含有碳碳双键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和水 | B. | 硝酸钾和氯化钠 | ||
| C. | 食盐水和泥沙 | D. | 乙酸丁酯和1-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
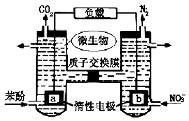
| A. | a电极为正极 | |
| B. | H+由右室通过质子交换膜进入左室 | |
| C. | a电极反应式为:C6H5OH-28e-+11H2O═6CO2↑+28H+ | |
| D. | 当b电极上产生lmol N2时,溶液中将有l0mol e-通过 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com