
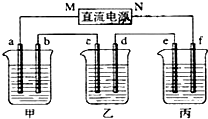
分析 乙中c电极质量增加,说明c是阴极,铜离子放电生成单质铜,所以M为原电池的负极,N为原电池的正极,甲池是电解水,电解水的质量为100g-95.5g=4.5g,由总的电解方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,进行分析求解.
解答 解:(1)乙中c电极质量增加,说明c是阴极,铜离子放电生成单质铜,所以M为原电池的负极,N为原电池的正极,故答案为:正极;
(2)电极a为阴极,阴极上发生的电极反应为2H2O+2e-=H2↑+2OH-,故答案为:2H2O+2e-=H2↑+2OH-;
(3)电极b上的电极反应式为:4OH--4e-=O2↑+2H2O,电解水的质量为100g-95.5g=4.5g,
由总的电解方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,
36g 22.4L
4.5g V
所以V=$\frac{4.5×22.4}{36}$=2.8L,所以生成的气体在标准状况下的体积是2.8L,故答案为:2.8L;
(4)电极c铜离子放电生成单质铜,根据电子守恒得2Cu~~O2,
2×64g 22.4L
m 2.8L
所以m=$\frac{2×64×2.8}{22.4}$=16g,故答案为:16g;
(5)电镀时,e是阴极,f是阳极,镀层锌作阳极,镀件铁作阴极,阳极上失电子变成离子进入溶液,阴极上锌离子得电子生成锌单质,所以阳极上电极反应式为Zn-2e-=Zn2+;阴极上的电极反应式为Zn2++2e-=Zn;
电镀液的选取:用含有镀层金属离子的溶液作电镀液,所以可选ZnSO4、Zn(NO3)2溶液作电镀液.
故答案为:铁;ZnSO4、Zn(NO3)2;Zn-2e-=Zn2+.
点评 本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等,做题时要正确写出电极方程式,准确判断两极上离子的放电顺序.


科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示氯化氢分子的形成过程: | |
| B. | 硫离子结构示意图: | |
| C. | 氢氧根的电子式: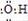 | |
| D. | HClO的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
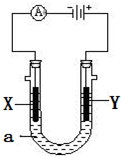 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
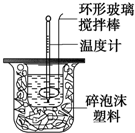 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结晶氯化钠 | B. | 金刚石 | C. | 碳酸钠 | D. | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中所有原子都在同一平面内 | |
| B. | 能与溴水发生加成反应使其褪色 | |
| C. | 能与浓HNO3在一定条件下发生取代反应 | |
| D. | 能与酸性KMnO4溶液反应使其褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
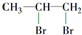 1,2二溴丙烷; ②
1,2二溴丙烷; ②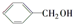 苯甲醇.
苯甲醇. C4H8O; ②
C4H8O; ②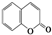 C9H6O2.
C9H6O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④⑥ | D. | ①②③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com