
【题目】按要求写出下列反应的化学方程式或离子方程式:
(1)Na和H2O反应的离子方程式___________________ ;
(2) Al2O3和NaOH反应的离子方程式___________________ ;
(3)Al和NaOH溶液反应的离子方程式___________________ ;
(4)Na2O2和CO2反应的化学方程式___________________ ;
(5) NaHCO3受热分解的化学方程式___________________ ;
(6)Fe与水蒸气在高温下反应化学方程式___________________ ;
【答案】2Na+2H2O===2Na++2OH-+H2↑ Al2O3+2OH-===2AlO2-+H2O 2Al+2OH-+2H2O===2AlO2-+3H2↑ 2Na2O2+2CO2===2Na2CO3+O2 2NaHCO3![]() Na2CO3+CO2↑+H2O 3Fe+4H2O(g)
Na2CO3+CO2↑+H2O 3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
【解析】
(1)钠与水反应生成氢氧化钠和氢气;
(2)Al2O3与NaOH溶液反应生成偏铝酸钠和水;
(3)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(4)Na2O2和CO2反应生成碳酸钠和氧气;
(5)NaHCO3受热分解生成碳酸钠和二氧化碳;
(6)Fe与水蒸气在高温下反应生成四氧化三铁和氢气。
(1)钠与水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;故答案为:2Na+2H2O===2Na++2OH-+H2↑;
(2)Al2O3与NaOH溶液反应生成偏铝酸钠和水,反应的离子方程式是:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-===2AlO2-+H2O;
(3)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O===2NaAlO2+3H2↑;
(4)Na2O2和CO2反应生成碳酸钠和氧气,化学方程式为:2Na2O2+2CO2===2Na2CO3+O2,故答案为:2Na2O2+2CO2===2Na2CO3+O2;
(5)NaHCO3受热分解生成碳酸钠和二氧化碳,化学方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O,故答案为:2NaHCO3
Na2CO3+CO2↑+H2O,故答案为:2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(6)Fe与水蒸气在高温下反应生成四氧化三铁和氢气,方程式为:3Fe+4H2O(g) ![]() Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g) ![]() Fe3O4+4H2。
Fe3O4+4H2。


科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是
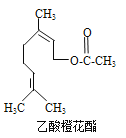
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A. ①②③B. ①②⑤C. ①②⑤⑥D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
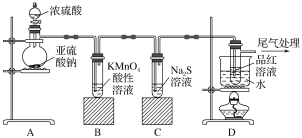
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是________,其中发生反应的化学方程式为_____。
(2)实验过程中,装置B、C中发生的现象分别是_____、 ____,这些现象分别说明SO2具有的性质是____和____。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________。
(4)尾气可采用________溶液吸收。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求用系统命法写出下列物质名称或结构简式
(1)用系统命法命名
①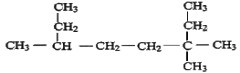 _________。
_________。
② 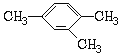 _________________。
_________________。
(2)顺-2-丁烯的结构简式为:____________。
(3)3-甲基-1-丁烯的结构简式为:_____________。
(4)2,2,3,3-四甲基戊烷的结构简式为:____________
(5)分子式为C5H10、核磁共振氢谱中只有一个峰的烃的结构简式_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
![]()
(1) 判断BaCl2已过量的方法是_______________________________________________。
(2) 第⑥步中,相关的离子方程式是______________________,_____________________。
(3) 为检验精盐纯度,需配制230mL0.2mol/L NaCl(精盐)溶液,则需用托盘天平称取精盐固体的质量为_____,需要的玻璃仪器有量筒、 烧杯、玻璃棒、____________、 __________。
(4) 配制NaCl(精盐)溶液时,若出现下列操作,造成结果偏低的是__________
A.称量时NaCl已潮解 B.称取时砝码与物体放反了
C.定容摇匀时,液面下降又加水 D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如下图,关于绿原酸判断正确的是( )

A.1 mol绿原酸与足量NaHCO3溶液反应,生成3 mol CO2气体
B.1 mol绿原酸与足量溴水反应,最多消耗2.5 mol Br2
C.1 mol绿原酸与足量NaOH溶液反应,最多消耗4 mol NaOH
D.绿原酸水解产物均可以与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g) + H2(g)ΔH=+139 kJ/mol
C4H8(g) + H2(g)ΔH=+139 kJ/mol
(1)该反应的化学平衡常数的表达式为_________________。
(2)一定条件下,以异丁烷为原料生产异丁烯。温度、压强改变对异丁烷平衡转化率的
影响如下图所示。
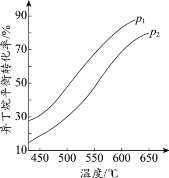
①判断p1、p2的大小关系:p1_________________(填“>”或“<”)p2,理由是_________________。
②若异丁烷的平衡转化率为40%,则平衡混合气中异丁烯的物质的量分数最多为______%(保留小数点后1位)。
(3)目前,异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-O为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以γ-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26.17 | 27.11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a.载体会影响催化剂的活性
b. 载体会影响催化剂的选择性
c.载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com