
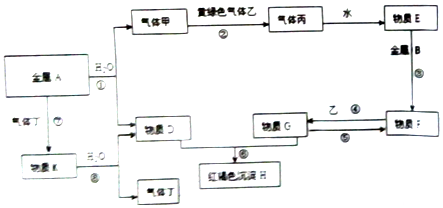
分析 金属A和水反应生成气体甲和物质D,气体甲和黄绿色气体乙反应生成气体丙,
物质D和G反应生成红褐色沉淀H,H为Fe(OH)3,A和气体丁反应生成C,C和水反应生成D和气体丁,则A应该是Na,丁的O2,C是Na2O2、D为NaOH,甲为H2,乙是Cl2,丙是HCl,E是盐酸,盐酸和B反应,B为Fe,则F为FeCl2,氯化亚铁和氯气反应生成FeCl3,结合题目分析解答.
解答 解:金属A和水反应生成气体甲和物质D,气体甲和黄绿色气体乙反应生成气体丙,物质D和G反应生成红褐色沉淀H,H为Fe(OH)3,A和气体丁反应生成C,C和水反应生成D和气体丁,则A应该是Na,丁的O2,C是Na2O2、D为NaOH,甲为H2,乙是Cl2,丙是HCl,E是盐酸,盐酸和B反应,B为Fe,则F为FeCl2,氯化亚铁和氯气反应生成FeCl3,
(1)D、G、H、丙分别为NaOH、FeCl3、氢氧化铁、氯化氢,
故答案为:NaOH;FeCl3;氢氧化铁;氯化氢;
(2)①为钠和水反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O=2Na++2OH-+H2↑;
③为Fe和稀盐酸反应生成氯化亚铁和氢气,离子方程式为Fe+2H+=Fe 2++H2↑;
④为亚铁离子和氯气的反应,生成氯化铁,离子方程式为2Fe 2++Cl2=2Fe 3++2Cl-;
⑧为过氧化钠和水反应生成氢氧化钠和氧气,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;Fe+2H+=Fe 2++H2↑;2Fe 2++Cl2=2Fe 3++2Cl-;2Na2O2+2H2O=4Na++4OH-+O2↑.
点评 本题无机物推断,为高频考点,涉及Fe、Na及其化合物之间的转化,明确元素化合物性质、物质特殊性质等知识点是解本题关键,注意基础知识的积累和归纳,题目难度不大.


科目:高中化学 来源: 题型:解答题
 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓ | |
| D. | 将氢氧化铁放入盐酸中:Fe(OH)3+3H+=Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,可用焦炭和石英砂(SiO2)制取高纯度硅 | |
| B. | CO2和钠在一定条件下可以得到金刚石和碳酸钠,反应中氧化剂和还原剂之比是4:1 | |
| C. | 用高纯度硅作为光导纤维的主要材料 | |
| D. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2[CuCl2溶液] | B. | AgNO3[Ag2O] | C. | NaCl[HCl溶液] | D. | CuSO4[CuSO4] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 蒸馏操作时,应将温度计插入蒸馏烧瓶内混合溶液中 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
| 0 | 0.80 | 1.00 | 0 |
| 1 | 0.70 | 0.80 | |
| 5 | 0.70 | ||
| 9 | 0.40 | ||
| 10 | 0.40 | 0.80 |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10-17 | 1.4×10-5 | 1.12×10-12 |
| A. | 由溶度积常数不能判断相应物质的溶解性大小 | |
| B. | 将等体积的4×10-3 mol/L的AgNO3溶液和4×10-3mol/L K2CrO4溶液混合,有Ag2CrO4沉淀产生 | |
| C. | 向AgCl的悬浊液中滴加饱和NaBr溶液不能得到黄色AgBr | |
| D. | 向100 mL 0.02mol/L的NaSO4溶液中加入100mL0.02mol/L的AgNO3溶液,有白色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com