
| A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) |
| B.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C.c(Na+)= c(HCO3-)+ 2c(CO32-)+ c(H2CO3) |
| D.c(Na+)+ c(H+)= c(HCO3-)+2c(CO32-) + c(OH-) |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:不详 题型:单选题
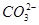 的物质的量浓度相同,则c1和c2的关系是
的物质的量浓度相同,则c1和c2的关系是| A.c1=2c2 | B.c1>c2 | C.c1=c2 | D.c1<c2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)+c(H+)=c(X-)+c(OH-) |
| B.c(HX)+c(X-)=c(Na+) |
| C.若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) |
| D.若混合液呈碱性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 |
| B.盐酸可作铁制品的除锈剂 |
| C.实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
| D.加热蒸干AlCl3溶液得到Al(OH)3固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)>c (CN-)>c(OH-)>c(H+) | B.c(HCN)+c(CN-)="0.04" mol/L |
| C.c(OH-)=c(H+)+c(HCN) | D.c(CN-)>c(HCN) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.01% | B.0.1% | C.0.2% | D.1% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)= c(HCO3-) |
| D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)= c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com