
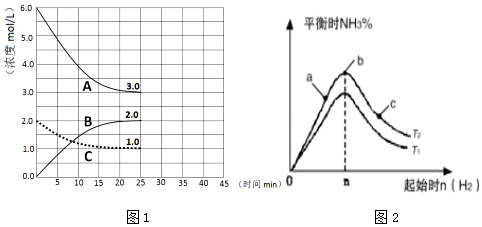
分析 (1)①根据图象可知,反应进行到25min时曲线A减少了6mol/L-3mol/L=3mol/L,C减少了2.0mol/L-1.0mol/L=1.0mol/L,因此根据方程式可知表示N2浓度变化的曲线是C,H2浓度变化的曲线为A,B为氨气的浓度变化曲线;
②前25 min内,氨气浓度增加了2.0mol/L,根据v=$\frac{△c}{△t}$计算用H2浓度变化表示的化学反应速率;
(2)①由图可知,n(H2)相同时,T2对应氨气含高,反应为放热反应,降低温度有利于生成氨气;
②a、b、c三点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大;
③当反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大,起始体系中加入1molN2、n=3molH2,反应达到平衡时H2的转化率为60%,则转化的氢气为1.8mol,则
N2(g)+3H2(g)?2NH3(g);
开始(mol):1 3 0
变化(mol):0.6 1.8 1.2
平衡(mol):0.4 1.2 1.2
以此计算平衡常数K,并结合平衡移动分析H2的转化率;
解答 解:(1)①根据图象可知,反应进行到25min时曲线A减少了6mol/L-3mol/L=3mol/L,C减少了2.0mol/L-1.0mol/L=1.0mol/L,因此根据方程式可知表示N2浓度变化的曲线是C,A浓度变化的曲线为H2,B为氨气的浓度变化曲线,
故答案为:A;
②前25 min内,氨气浓度增加了2mol/L,则用NH3浓度变化表示的化学反应速率是$\frac{2mol/L}{25min}$=0.08 mol•L-•min-1,
故答案为:0.08 mol•L-•min-1;
(2)①由图可知,n(H2)相同时,T2对应氨气含高,反应为放热反应,降低温度有利于生成氨气,则T2<T1 ,故答案为:<;
②a、b、c三点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大,c点时氢气的物质的量最大,c点N2的转化率最高,此时氢气起始量最大达到平衡状态下H2的百分含量最高,故答案为:c;c;
③当氮气和氢气的物质的量之比为1:3时达平衡状态时氨的百分含量最大,平衡点时产物的产率最大,据图示,当平衡时氢气的物质的量为n,故加入N2的物质的量为$\frac{\\;n}{3}$,起始体系中加入1molN2、n=3molH2,反应达到平衡时H2的转化率为60%,则转化的氢气为1.8mol,则
N2(g)+3H2(g)?2NH3(g);
开始(mol):1 3 0
变化(mol):0.6 1.8 1.2
平衡(mol):0.4 1.2 1.2
容器容积为1L,平衡浓度分别为0.4mol/L、1.2mol/L、1.2mol/L,
则平衡常数K=$\frac{(1.2)^{2}}{0.4×(1.2)^{3}}$=2.08(mol/L)-2,
故答案为:$\frac{n}{3}$;2.08;
点评 本题考查化学反应速率、化学平衡计算、外界条件对化学平衡移动影响,为高频考点,侧重考查学生分析计算能力,注意:当反应物的物质的量之比等于计量数之比时反应物的转化率相同、产物的含量最大,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 124g P4含有的P-P键数为4NA(设NA表示阿伏伽德罗常数的值) | |
| B. | Be和NaOH溶液反应的离子方程式是:2Be+2OH -+2H2O=2BeO2-+3H2↑ | |
| C. | 在NaCl溶液中加入AgNO3溶液,生成白色沉淀;再加入氨水,沉淀消失,沉淀消失发生的离子方程式是: AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O | |
| D. | 0.1mol/L的Fe3+溶液中,能大量共存的离子有Cl-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为保护海轮的船壳,常在船壳上镶入锌块 | |
| B. | 纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应 | |
| C. | 已知工业合成氨△H<O,达平衡后,升高温度,正反应速率减少、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | NH3(g)+HCl(g)═NH4Cl(s)较低温下能自发进行,说明该反应的△H<O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大 | |
| B. | 甲烧杯中的酸过量 | |
| C. | 甲烧杯比乙烧杯反应快 | |
| D. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混凝法,用明矾做混凝剂:Al3++3H2O?Al(OH)3+3H+ | |
| B. | 中和法,用过量CO2中和碱性废水:CO2+2OH-═CO32- | |
| C. | 沉淀法,用Na2S处理含Hg2+废水:Hg2++S2-═HgS↓ | |
| D. | 氧化还原法,用FeSO4将酸性废水中Cr2O72-还原为Cr3+:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com