
分析 8.1gAl的物质的量为$\frac{8.1g}{27g/mol}$=0.3mol,HCl物质的量为0.25mol×4mol/L=1mol,由2Al+6HCl=2AlCl3+3H2↑可知,Al完全反应,盐酸有剩余,向反应后的溶液中逐渐加入NaOH溶液,反应生成氢氧化铝为$\frac{7.8g}{78g/mol}$=0.1mol<0.3mol,说明有两种情况:(1)反应后溶液中溶质为AlCl3和NaCl,(2)若加入的NaOH过量,反应后溶液中溶质为NaAlO2和NaCl,再结合原子守恒计算解答.
解答 解:8.1gAl的物质的量为$\frac{8.1g}{27g/mol}$=0.3mol,HCl物质的量为0.25mol×4mol/L=1mol,由2Al+6HCl=2AlCl3+3H2↑可知,Al完全反应,盐酸有剩余,向反应后的溶液中逐渐加入NaOH溶液,反应生成氢氧化铝为$\frac{7.8g}{78g/mol}$=0.1mol<0.3mol,说明有两种情况:
(1)反应后溶液中溶质为AlCl3和NaCl,
由Al原子守恒,溶液中的AlCl3为0.3mol-0.1mol=0.2mol,
根据氯原子守恒:n(NaCl)=1mol-0.2×0.3mol=0.4mol,
根据Na原子守恒:n(NaOH)=0.4mol,
故V(NaOH)=$\frac{0.4mol}{4mol/L}$=0.1L,即为100mL,
(2)若加入的NaOH过量,反应后溶液中溶质为NaAlO2和NaCl,
则溶液中的NaAlO2为0.3mol-0.1mol=0.2mol,
根据氯原子守恒:n(NaCl)=n(HCl)=1mol,
根据Na原子守恒:n(NaOH)=1.2mol
V(NaOH)=$\frac{1.2mol}{4mol/L}$=0.3L,即为300mL,
答:加入的NaOH溶液的体积可能为100mL或300mL.
点评 本题考查方程式的有关计算,题目难度中等,关键是根据氯化铝与氢氧化铝的量讨论判断发生后溶液中溶质,再结合守恒法计算解答,侧重考查学生分析计算能力.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
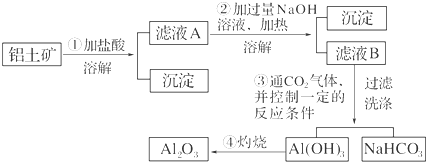
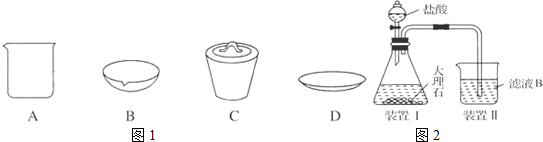
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向某溶液中加入BaCl2溶液,有白色沉淀,则原溶液一定存在Ag+或SO42- | |
| B. | 根据纤维在火焰上燃烧产生的气味,可确定该纤维是否为蛋白质纤维 | |
| C. | 两份常温下均为饱和溶液(一份是NaOH溶液,一份是氢氧化钾溶液),上述两份饱和溶液可通过加入少量的NaOH固体而鉴别出 | |
| D. | 某矿石中加入足量的盐酸,根据放出的二氧化碳气体,可证明该矿石一定含有碳酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③④⑤ | C. | ①③⑤⑥ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠和冷水反应 Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O | |
| D. | 少量NaHCO3溶液与Ca(OH)2溶液反应:OH-+HCO3-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中B2O3是氧化剂 | B. | 若消耗2.24LNH3理论上可得2.5gBN | ||
| C. | 填料的作用可使反应物充分接触 | D. | 反应时NH3需要用无水CaCl2干燥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com