
飓风“桑迪”,是由于气候变暖而形成于大西洋洋面上的一级飓风。2012年10月30日上午6点45分,飓风“桑迪”在新泽西州登陆,截至11月4日上午,已导致美国113人死亡,联合国总部受损。下列与飓风“桑迪” 的形成关系最为密切的是
A.NO2 B.SO2 C.CO2 D.CO
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
下列表示物质结构的化学用语或模型正确的是( )
A.羟基的电子式: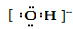 B.CH4 分子的球棍模型:
B.CH4 分子的球棍模型:
C.乙烯的实验式:CH2 D.苯乙醛结构简式: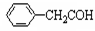
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省周口市高一下学期期中考试化学试卷(解析版) 题型:选择题
参照反应Br+H2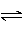 HBr+H的能量对反应历程的示意图。下列叙述正确的是
HBr+H的能量对反应历程的示意图。下列叙述正确的是
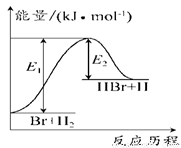
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中文科化学试卷(解析版) 题型:选择题
下列关于食品添加剂的说法不正确的是
A.亚硝酸钠可以致癌
B.我们应该禁止使用防腐剂
C.苯甲酸钠可用作防腐剂
D.绝大多数食品添加剂在过量使用时对人体有害的
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中文科化学试卷(解析版) 题型:选择题
钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H+ + 2e—=H2↑ B.Fe2+ + 2e—=Fe
C.2H2O + O2 + 4e—=4OH— D. Fe3+ + e—=Fe2+
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:填空题
某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用。某校研究小组尝试回收废旧正极材料中的钴。
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
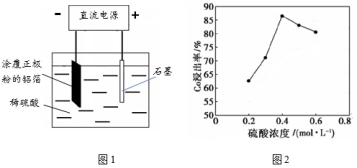
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、 。
阳极的电极反应式为 。
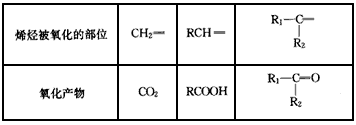
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol/L时,钴的浸出率下降,其原因可能为
。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式: 。该步骤一般在80℃以下进行,温度不能太高的原因是 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
A.c(NH4+) > c(C2O42-) > c(H+) > c(OH-)
B.c(H+) + c(NH4+) = c(C2O42-) + c(OH-) + c(HC2O4-)
C.c(NH4+) + c(NH3·H2O) = 2[c(C2O42-) + c(HC2O4-) + c(H2C2O4 )]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2 的质量分数为a%,则回收后得到CoC2O4·2H2O 的质量不高于 g。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.测定相同温度下盐酸和醋酸溶液的pH,可证明盐酸是强酸、醋酸是弱酸
B.改变温度能改变任何可逆反应的平衡状态
C.离子反应的结果是自由移动的离子浓度减小
D.Fe(OH)3胶体和饱和FeCl3溶液都呈红褐色,可通过丁达尔效应区分二
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二下期中化学试卷(解析版) 题型:选择题
烯烃或炔烃在酸性高锰酸钾溶液作用下,分子中的不饱和键完全断裂,此法可用于减短碳链或利用产物反推不饱和烃的结构等。已知烯烃与酸性 KMnO4溶液反应的氧化产物的对应关系为
现有某烯烃与酸性KMnO4溶液作用后得到的氧化产物有CO2、乙二酸(HOOC-COOH)和丙酮 (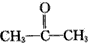 ),则该烯烃结构简式可能是
),则该烯烃结构简式可能是
A.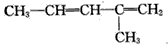
B.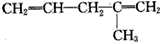
C. CH2=CH-CH=CHCH2CH3
D.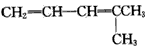
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:填空题
W、X、Y、Z、M、G五种短周期元素,原子序数依次增大。W,Z同主族,可形成离子化合物ZW;Y , M同主族,可形成MY2, MY3两种分子;X的气态氢化物水溶液呈碱性。
请回答下列问题:
(1)Y在元素周期表中的位置为 ;
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是 (写化学式)
(3) W、Y、Z、G形成的简单离子的半径大小顺序是 (用化学符号表示)
(4)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 (任写两个)
(5)Y与M的氢化物中,热稳定性差的是 (填化学式),沸点高的是 (填化学式)
(6)ZW的电子式为 ,W2Y2的电子式为 ,用电子式表示Z2M的形成过程: 。
(7)MY2和G2均能使品红溶液褪色,常温常压下若将相同体积的MY2和G2气体同时通入品红溶液,品红溶液 (填“褪色”或“不褪色”),请用相关离子方程式解释原因 。
(8)已知
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(9)最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N入出942kJ。根据以上信息和数据,下列说法正确的是 。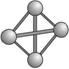
A.N4属于一种新型化合物 B.N4晶体熔点高,硬度大
C.相同质量的N4的能量高于N2 D.1molN4转变为N2将吸收882kJ的能量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com