
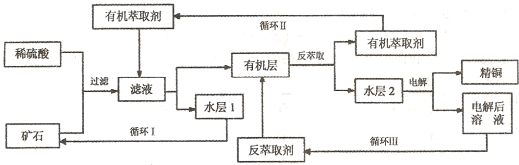
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和大量脉石(SiO2),现采用酸浸法从矿石中提取铜,其流程图如下:

已知: ①当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;②反萃取后的水层是硫酸铜溶液,Cu2+浓度约为50g/L。回答下列问题:
(1)矿石用稀硫酸浸出过程中氧化亚铜发生的反应为:Cu2O+2H+===Cu2++Cu+H2O;请写出该过程中发生的另一个氧化还原反应的离子方程式: 。
(2)写出用惰性电极电解水层的电解总反应方程式: 。
(3)循环中反萃取剂B的主要成分是 。
(4)某铜矿石样品中,若仅含氧化亚铜、三氧化二铁和脉石三种物质。取该矿石样品200.0g,用100mL1.0mol?L—1H2SO4溶液浸取后,还需加入10mL 1.0mol?L—1 Fe2(SO4)3溶液才能使铜全部浸出,浸取液经充分电解后可得到 6.4gCu。求铜矿石样品中氧化亚铜和氧化铁的质量分数?
(12分)(1)Cu+2Fe3+=2Fe2++ Cu2+(2分)
(2)2CuSO4 + 2H2O  O2↑+ 2Cu + 2H2SO4(2分)
O2↑+ 2Cu + 2H2SO4(2分)
(3)H2SO4(2分) (4)Cu2O:3.6% (3分) Fe2O3:3.2%(3分)
【解析】
试题分析:(1)氧化铜、三氧化二铁均可以和强酸发生反应生成盐和水,CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O。而金属铜和三价铁之间可以发生氧化还原反应,即Cu+2Fe3+=2Fe2++Cu2+。
(2)惰性电极电解硫酸铜的化学方程式是2CuSO4 + 2H2O  O2↑+ 2Cu + 2H2SO4。
O2↑+ 2Cu + 2H2SO4。
(3)由于硫酸铜易溶在无机溶剂中,所以循环中反萃取剂B的主要成分是稀硫酸。
(4)电解后生成的铜的质量是6.4g,物质的量是0.1mol,则根据原子守恒可知氧化亚铜的物质的量是0.05mol,所以铜矿石样品中氧化亚铜质量分数是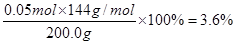 ;
;
根据方程式Cu2O+2H+=Cu2++Cu+H2O,反应中生成的铜是0.05mol。则根据Cu+2Fe3+=2Fe2++ Cu2+可知与铜反应的硫酸铁是0.05mol,其中有0.01L×1.0mol/L=0.01mol硫酸铁是另外加入的,则氧化铁和稀硫酸反应生成的硫酸铁是0.04mol,则氧化铁的物质的量是0.04mol,所以氧化铁的质量分数是 。
。
考点:考查氧化还原反应方程式、电解反应式的书写、萃取剂的选择以及物质含量的计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难易适中,侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导,有利于培养学生的逻辑思维能力和发散思维能力。该类试题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
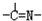 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=查看答案和解析>>
科目:高中化学 来源:2011届广东省深圳高级中学高三高考前最后模拟试卷(理综)化学部分 题型:实验题
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。
已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜; ③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O
、 (写其中2个)
(2)将有机层和水层分离的操作方法叫 ,实验式完成此操作所用到的一种主要仪器是 。
(3)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是 。
(4)写出电解过程中(两电极都是惰性电极)阴极发生反应的电极反应式
(5)“循环Ⅲ”中反萃取剂的主要成分是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com