
| A. | (M+3N)mol | B. | ($\frac{M}{2}$+3N)mol | C. | ($\frac{M}{2}$+3N+$\frac{7}{2}$W)mol | D. | ($\frac{M}{2}$+3N-$\frac{7}{2}$W)mol |
分析 反应后的混合气体燃烧生成CO2和H2O,根据原子守恒可知,反应后混合气体的耗氧量即是Mmol H2和Nmol C2H4燃烧的耗氧量,根据C原子、H原子守恒计算出CO2和H2O的物质的量,再根据O原子守恒计算消耗的氧气物质的量.
解答 解:反应后的混合气体燃烧生成CO2和H2O,根据原子守恒可知,反应后混合气体的耗氧量即是Mmol H2和Nmol C2H4燃烧的耗氧量,
根据碳原子守恒n(CO2)=2n(C2H4)=2N mol,根据H原子守恒n(H2O)=2n(C2H4)+n(H2)=(2N+M)mol,
根据O原子守恒,则2n(O2)=2n(CO2)+n(H2O)=4N mol+(2N+M)mol=(6N+M)mol,
则消耗的氧气的物质的量n(O2)=(3N+0.5M)mol,
故选B.
点评 本题考查混合物的计算,关键是对加成反应的理解与原子守恒运用,侧重分析计算能力的考查,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 甲 | 乙 |
| A | 溴乙烷水解制备乙醇 | 乙烯水化制备乙醇 |
| B | 甲烷与氯气反应制备四氯化碳 | 乙烯通入KMnO4溶液中 |
| C | 甲苯与KMnO4溶液反应生成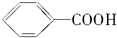 | 苯与液溴反应制备溴苯 |
| D | 蛋白质水解得到氨基酸 | 乙醇与冰醋酸反应生成乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:H3PO4>H2SO4>HClO4 | B. | 离子半径大小:F->Na+>Mg2+>Al3+ | ||
| C. | 稳定性大小:SiH4<PH3<H2S<HCl | D. | 碱性强弱:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇所含的分子数为NA | |
| B. | 1mol/LCaCl2溶液中含有的氯离子数目为2NA | |
| C. | 1 mol金属钠在足量乙醇完全反应转移的电子数为2NA | |
| D. | 1.6g 甲烷中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3 熔点高,可用于制作耐高温仪器 | |
| B. | 水果、蔬菜等是碱性食物 | |
| C. | 高纯度的硅单质可用于制作光导纤维 | |
| D. | 绿色化学的核心是从源头上杜绝污染的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
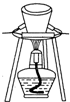
| A. | 用湿润的pH试纸测定溶液的pH | |
| B. | 用如图所示装置灼烧碱式碳酸铜[Cu2(OH)2CO3]制取氧化铜 | |
| C. | 用铜丝蘸取草木灰在酒精灯火焰灼烧检验钾元素 | |
| D. | 称取0.4g NaOH,放入100mL容量瓶中,加入蒸馏水溶解,用胶头滴管定容至刻度线,振荡摇匀,配制100mL 0.10mol/L NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有 乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液, 加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明HCOOH结构中含有醛 基 | 将1mL 1mol/L HCOOH溶液加入装有银氨溶液 的试管中并水浴加热,观察有无银镜产生 |
| C | 除去甲烷中的乙烯 | 将混合气通入KMnO4溶液中洗气 |
| D | 制取乙烯气体 | 将无水乙醇和浓硫酸混合加热到140℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O的摩尔质量为18g | |
| B. | 3.01×1023个SO2分子的质量为32g | |
| C. | 标准状况下,1 mol任何物质体积均为22.4L | |
| D. | 将0.1mol NH3溶于1L水,配成溶液中溶质的物质的量浓度为0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com