
分析 (1)依据氮原子的原子序数是7,结合原子结构示意图分析判断;
(2)依据盖斯定律,结合题干热化学方程式计算写出;
(3)把握燃烧热的概念,结合盖斯定律来解.
(4)碱性电池中负极发生还原反应,也就是还原剂失电子的反应,结合电解质溶液为碱性条件解答.
解答 解:(1)氮元素原子的原子序数为7,原子的L层电子数为5,
故答案为:5;
(2)①N2(g)+2O2(g)=N2O4(l)△H1=-19.5kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol,
故答案为:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol;
(3)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,此时生成的水必须为液态,可燃物必须为1mol,
已知反应:①N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
②H2O(l)═H2O(g)△H3=+44kJ•mol-1
将①-2×②可得:N2H4(l)+O2 (g)=N2(g)+2H2O(l)△H2=-622.2kJ•mol-1
故答案为:N2H4(l)+O2 (g)=N2(g)+2H2O(l)△H2=-622.2kJ•mol-1;
(4)负极发生氧化反应,是肼在反应,肼中的N从-2价升高到0价,碱性电池中,其电极反应式应为:N2H4+4OH--4e-=N2+4H2O,
故答案为:N2H4+4OH--4e-=N2+4H2O.
点评 本题考查较为综合,涉及原子结构示意图、化学方程式的书写、盖斯定律内容及应用,题目难度中等,明确盖斯定律的内容为解答关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 含2.8 mol电子的Mg34S晶体中34S所含中子数为1.8NA | |
| B. | 17gH2O2中所含极性键总数为0.5NA | |
| C. | 31gFeI2与足量氯气反应时转移的电子数为0.2NA | |
| D. | 以Mg、Al为电极,NaOH 溶液为电解质溶液的原电池中,若正极生成的H2体积为22.4L,导线上流过2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1AlCl3 溶液中,含 Al3+数目小于 NA | |
| B. | 标准状况下,6.0gNO 和 2.24LO2混合,所得气体的分子数目为 0.2NA | |
| C. | 25℃,1LpH=1 的稀硫酸中含有的 H+数为 0.2NA | |
| D. | 由 1molCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为NA 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
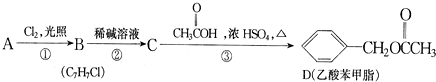
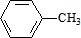 、
、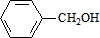 .
.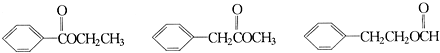
 、
、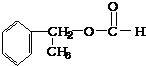 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
 :
:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
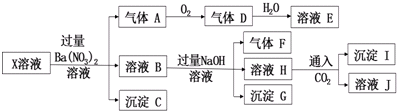
| A. | 气体A是无色有刺激性气味的有毒气体 | |
| B. | X中肯定存在Fe2+、Mg2+、NH4+、SO42- | |
| C. | 沉淀I中加入过量溶液E,沉淀完全溶解 | |
| D. | X中不能确定的阳离子只有A13+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com