
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和 c.实验①和 |
| ② | ||||
| ③ | ||||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
| △c |
| △t |
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | a.实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; b.实验①和③探究温度对该反应速率的影响; c.实验①和④探究催化剂对该反应速率的影响; | |||
| ② | 298 | 0.5 | 0.001 | |
| ③ | 323 | 0.5 | 0.01 | |
| ④ | 298 | 0 | 0.01 |
| 0.001mol?L -1×0.004L |
| 0.004L+0.002L |
| 6min+7min+7min |
| 3 |
| △c |
| △t |
| 0.00067mol?L -1 |
| 6.7min |
| △c |
| △t |


科目:高中化学 来源: 题型:
| A、标准状况下,22.4LH2O含有的原子总数为3NA |
| B、常温常压下,含有NA个氖原子的氖气体积约为22.4L |
| C、4g金属钙变成钙离子时失去的电子数目为0.1NA |
| D、2L0.5mol?L-1的氯化镁溶液中所含的离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH(固体) |
| B、H2O |
| C、HCl |
| D、CH3COONa(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:
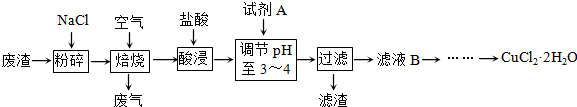
| ||
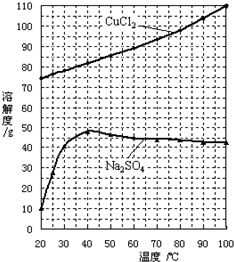
查看答案和解析>>
科目:高中化学 来源: 题型:
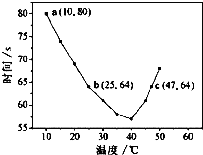 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A、40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B、温度高于40℃时,淀粉不宜用作该实验的指示剂 |
| C、图中a点对应的NaHSO3平均反应速率为2.5×10-4mol?L-1?s-1 |
| D、图中b、c两点对应的NaHSO3反应速率:b<c |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现在七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答下列问题.
现在七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答下列问题.| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B原子L层有2个未成对电子 |
| C元素原子的核外p电子数比s电子数少1 |
| D元素最外层电子数是电子层数的3倍 |
| E原子的第一到第四电离能分别是:I1=738kJ/mol、I2=1451kJ/mol、I3=7733kJ/mol、I4=10540kJ/mol |
| F是前四周期中电负性最小的元素 |
| G原子核外M层全充满,N层只有1个电子 |
 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能与金属钠反应放出氢气 |
| B、能发生加聚反应生成高分子化合物 |
| C、能与新制氢氧化铜反应 |
| D、能与溴水发生氧化反应使其褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com