
分析 (1)根据电中性微粒化学性质稳定说明是具有稳定结构原子;
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒是硫离子,阴离子:质子数=核外电子数-所带电荷数;
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒为钾离子;
(4)该微粒的还原性很弱,失去一个电子后变为原子,原子的氧化性很强,这种微粒为氯离子.
解答 解:(1)根据题意可知:电中性微粒化学性质稳定,是具有稳定结构原子,质子数等于核外电子数为18,该粒子为Ar,故答案为:Ar;
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒是硫离子,故答案为:S2-;
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒为钾离子,故答案为:K+;
(4)该微粒的还原性很弱,失去一个电子后变为原子,原子的氧化性很强,这种微粒为氯离子,故答案为:Cl-.
点评 本题考查核外电子排布式均为1s22s22p63s23p6即核外共有18个电子,要注意阴离子:质子数=核外电子数-电荷数,阳离子=核外电子数+电荷数.


科目:高中化学 来源: 题型:选择题
| A. | NaOH、H2SO4、(NH4)2SO4 | B. | MgO、Na2SO4、NH4HCO3 | ||
| C. | Na2O2、NH4Cl、Na2SO4 | D. | HCl、Al2O3、MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质中不一定含有氧元素 | |
| B. | 该物质的分子组成必须满足n(C)=n(H) | |
| C. | 该物质中一定含有氧元素,且必须满足n(C)=n(O) | |
| D. | 该物质一定不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物 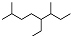 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段为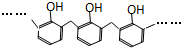 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二种粒子是氧元素的另一种核素 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “四中子”不显电性 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
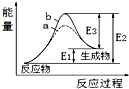
| A. | 该反应为放热反应 | |
| B. | b表示的有催化剂 | |
| C. | 催化剂能降低正、逆反应的活化能 | |
| D. | 逆反应的活化能大于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 1mol贝诺酯分子可与6molH2完全反应 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| D. | 乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
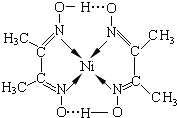 分子内含有的作用力有ACE(填序号).
分子内含有的作用力有ACE(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | X表示HA,Y表示OH,Z表示H+ | D. | 该混合溶液中:c(A-)+c(Y)=c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com