

分析 (1)依据已知热化学方程式构建目标方程式,根据盖斯定律计算得到目标方程式的反应热;
(2)①从图示1可知在低于800℃时主要还原产物为CaS,高于800℃时主要发生硫化钙和硫酸钙反应生成氧化钙和二氧化硫;
②无氯化钙和有氯化钙存在的反应,最终平衡相同,仅改变反应历程,所以CaCl2为催化剂;当温度高于1200℃时,达到平衡,因催化剂不能改变平衡,所以无论有无CaCl2,CaSO4的转化率趋于相同.
解答 解:(1)已知①CaSO4•2H2O(s)═CaSO4•$\frac{1}{2}$H2O(s)+$\frac{3}{2}$H2O(g)△H1=+83.2kJ•mol-1
②CaSO4•2H2O(s)═CaSO4(s)+$\frac{3}{2}$H2O(l)△H2=+26kJ•mol-1
③H2O(g)═H2O(l)△H3-44kJ•mol-1
将②-③×2-①得CaSO4•$\frac{1}{2}$H2O(s)═CaSO4(s)+$\frac{1}{2}$H2O(g),则△H4=[26kJ•mol-1-(-44kJ•mol-1)×2-83.2kJ•mol-1]=30.8kJ•mol-1,
故答案为:30.8;
(2)①从图示1可知,在低于800℃时,CaS成分的物质的量为1,而CaO的物质的量几乎为0,所以在低于800℃时主要还原产物为CaS,高于800℃时主要发生硫化钙和硫酸钙反应CaS+3CaSO4$\frac{\underline{\;高温\;}}{\;}$4CaO+4SO2↑,氧化钙的物质的量增加,硫化钙的物质的量减小,
故答案为:CaS;CaS+3CaSO4$\frac{\underline{\;高温\;}}{\;}$4CaO+4SO2↑;
②催化剂仅能改变反应的速率,改变反应历程,但不能改变化学平衡,从图示可知,当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,所以CaCl2的作用是作催化剂,当温度高于1200℃时,无论有无CaCl2,CaSO4的反应两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动,
故答案为:作催化剂;两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动.
点评 本题考查反应热的计算、化学平衡移动影响因素、化学方程式的书写,掌握盖斯定律的熟练应用以及催化剂对平衡的影响是解答关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 干冰中的分子间作用力和单质碘中的分子间作用力 | |
| B. | CsCl晶体中与一个Cl-紧邻的Cs+数和NaCl晶体中与一个Cl-紧邻的Na+数 | |
| C. | 晶体硅中Si-Si键的键能和金刚石中C-C键的键能 | |
| D. | 水分子中O-H键的键角和甲烷分子中C-H键的键角 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
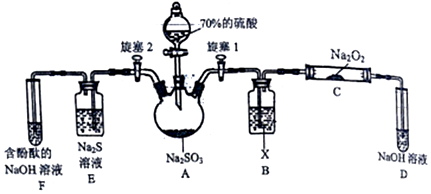
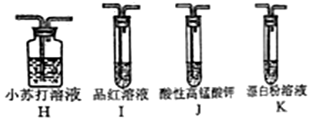
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当0<b<$\frac{a}{3}$时:SO2+H2O+3ClO-=SO42-+2HClO+Cl- | |
| B. | 当b=a时,SO2+H2O+ClO-═2H++Cl-+SO42- | |
| C. | 当$\frac{a}{3}$≤b≤a时,反应后溶液中H+的物质的量:0<n(H+)≤2bmol | |
| D. | 当0<b<a时,反应后溶液中ClO-、Cl-和SO42-物质的量之比为:(a-b):b:b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠露置在空气中,光亮表面颜色变暗:4Na+O2═2Na2O | |
| B. | 硫酸铵溶液与氢氧化钡溶液混合,产生气体:NH4++OH-═NH3↑+H2O | |
| C. | 铝条插入烧碱溶液中,开始没有明显现象:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 碘化银悬浊液滴加硫化钠溶液,黄色沉淀变成黑色:2AgI+S2-═Ag2S+2I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| HClO | K=3×10-9 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A. | 原溶液中:c(ClO-)>c(OH-)>c(H+) | |
| B. | 原溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 反应后溶液中 c(HClO)>c(HCO3-)>c(ClO)>c(CO32-) | |
| D. | 反应后溶液中 c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)+c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3═Fe3++3OH- | B. | KHSO4?K++H++SO42- | ||
| C. | NH4HCO3═NH4++HCO3- | D. | NaH2PO4═Na++2H++PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氧是单质 | B. | 煤油是从煤中分离出来的 | ||
| C. | 液氧在燃烧过程中作氧化剂 | D. | 煤油作燃料污染小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com