
| 结果 加入物质 变量 | H2O | NH4Cl(s) | NaOH(s) | 浓盐酸 |
| (1)c(NH3•H20) | ||||
| (2)n(OH-) | ||||
| (3)c(OH-) | ||||
| (4)电离平衡移动方向 |
分析 氨水中存在电离平衡NH3•H20?NH4++0H-,电离是吸热的过程,温度升高,电离程度增大;通入氨气会使其浓度增大,电离程度减小;加水稀释促进电离;增大铵根离子浓度会抑制电离;通入二氧化碳会和氢氧根离子之间反应,消耗氢氧根离子,所以平衡右移,据影响电离平衡移动的因素来回答.
解答 解:(1)加水稀释会使氨水浓度减小,电离平衡正向移动,电离度增大,氢氧根离子的物质的量增大,氢氧根离子浓度减小,碱性增强;
(2)加入少量氯化铵固体,增大了铵根离子浓度,电离平衡逆向移动,c(NH3•H20)减小,电离程度减小,氢氧根离子浓度减小,碱性减弱;
(3)加入少量氢氧化钠固体,氢氧根离子物质的量和浓度增加,碱性增强,但是电离平衡逆向移动,c(NH3•H20)增大,氢氧根离子浓度增大;
(4)加入浓盐酸,消耗氢氧根离子,电离平衡向正方向移动,c(NH3•H20)减小,氢氧根离子的物质的量减小,氢氧根离子浓度减小;
故答案为:
| 结果 加入物质 变量 | H2O | NH4Cl(s) | NaOH(s) | 浓盐酸 |
| (1)c(NH3•H20) | 减小 | 增大 | 增大 | 减小 |
| (2)n(OH-) | 增大 | 减小 | 减小 | 减小 |
| (3)c(OH-) | 减小 | 减小 | 增大 | 减小 |
| (4)电离平衡移动方向 | 正方向 | 逆方向 | 逆方向 | 正方向 |
点评 本题考查学生影响化学平衡移动的因素:温度、浓度、同离子效应等知识,注意知识的归纳和梳理是关键,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
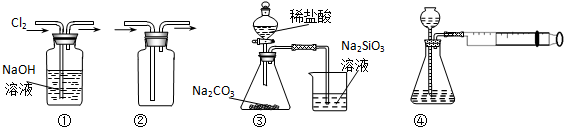
| A. | 装置①可用于除去Cl2中含有的少量HCl气体 | |
| B. | 装置④向左推动针筒活塞可检验该装置的气密性 | |
| C. | 装置③可证明非金属性Cl>C>Si | |
| D. | 按装置②所示的气流方向可用于收集H2、NH3等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥ | B. | ②④⑤⑥ | C. | ⑤⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:| A. | 放电时:电子流动方向由A经导线流向B | |
| B. | 放电时:正极反应是Pb-2e-+SO42-═PbSO4 | |
| C. | 放电时:当电路中转移0.2mol电子时,消耗的H2SO4 0.4mol | |
| D. | 放电时:外电路通过1mol电子时,理论上负极板的质量增加48g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 元素X和元素W最高正价代数和一定为8 | |
| B. | 若元素X的原子序数为a,则Z的原子序数一定为a+9. | |
| C. | 常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物 | |
| D. | 原子半径的大小顺序为rW>rZ>rX>rY. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g石墨烯(单层石墨)中含有C-12原子的个数为NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1 NA | |
| D. | 1 mol的羟基与1 moL的甲基所含电子数均为9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com