
【题目】完成下列问题 I.某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验:
①取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4 , 振荡后静置,观察到下层液体呈紫红色;
②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色.
(1)写出实验②中发生氧化还原反应的离子方程式: .
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是 .
A.Br2>I2
B.Fe3+>Br2
C.Br2>Fe3+
D.I﹣>Br﹣
(3)II.被誉为“江南小三峡”的南京胭脂河是明代初年开凿的一条人工运河.因其“石有胭脂色”而得名.胭脂河沿岸的那些红色石块的成分是什么?某研究性学习小组取一小块这种红色石块A,粉碎后对其成分进行实验探究,实验记录如图所示. 
请你根据使用推断:
A中含有的酸根离子(填离子符号).B中肯定含有的溶质是(写化学式).
写出实验中有关反应的化学方程式:
②
⑤ .
【答案】
(1)Fe2++Br2=2Fe3++2Br﹣
(2)AC
(3)CO32﹣; FeCl3;CO2+Ca(OH)2=CaCO3↓+H2O; Fe+CuSO4=Cu+FeSO4
【解析】解:Ⅰ.(1)验②中亚铁离子被溴氧化成铁离子,反应的离子方程式为2Fe2++Br2=2Fe3++2Br﹣,
所以答案是:Fe2++Br2=2Fe3++2Br﹣;(2)根据实验①有Br2的氧化性强于I2,实验②有Br2的氧化性强于Fe3+,所以答案是:AC;
Ⅱ.由以上分析可知A含有碳酸钙、氧化铁,则含有的原子团为CO32﹣,黄色说明溶液中一定含有铁离子,则溶质为FeCl3,
所以答案是:CO32﹣;FeCl3;②为二氧化碳与澄清石灰水的反应,方程式为CO2+Ca(OH)2=CaCO3↓+H2O,⑤为铁与硫酸铜的反应,方程式为Fe+CuSO4=Cu+FeSO4,
所以答案是:CO2+Ca(OH)2=CaCO3↓+H2O;Fe+CuSO4=Cu+FeSO4.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】对化学反应限度的叙述,错误的是
A. 任何可逆反应都有一定的限度B. 化学反应达到限度时,正逆反应速率相等
C. 化学反应的限度是不可改变的D. 化学反应的限度与时间的长短无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组鉴别甲的过程与现象如图所示(已知甲是一种盐).下列结论正确的是( ) 
A.如果甲中含有S2﹣ , 则乙是硫磺沉淀
B.如果乙是AgCl沉淀,那么甲是FeCl3
C.丙中肯定含有Fe3+ , 所以甲是FeBr2
D.甲中含有铁元素,可能显+2价或+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是
A.0.5 mol锌粒与足量盐酸反应产生11.2 L H2
B.标准状况下,11.2 L CCl4所含分子数为0.5NA
C.0.1 mol CH4所含氢原子数为0.4NA
D.常温常压下,28 g N2中所含原子个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: 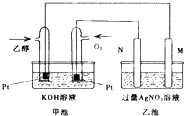
(1)M电极的材料是 , 电极名称是 , 加入乙醇的铂电极的电极反应式为 .
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为mL(标准状况下).
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量表示该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
(1)Cu2+基态的电子排布式可表示为;
(2)SO42﹣的空间构型为(用文字描述);中心原子采用的轨道杂化方式是;写出一种与SO42﹣互为等电子体的分子的化学式:;
(3)向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4]2﹣ . 不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 .
(5)CuS比CuO的熔点(填高或低),原因是 .
(6)闪锌矿的主要成分ZnS,晶体结构如图所示,其晶胞边长为540.0pm,密度为(列式并计算),a位置S2﹣离子与b位置Zn2+离化学﹣选修5:有机化学基础子之间的距离为pm(列式表示). 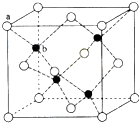
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用20mL 18.4molL﹣1 浓H2SO4与金属铜共热一段时间后,冷却,过滤,除去多余的铜,将滤液加水稀释到100mL,所得溶液中SO42﹣的物质的量浓度为3.18molL﹣1 , 则此时溶液中CuSO4的物质的量浓度为( )
A.0.50 molL﹣1
B.0.75 molL﹣1
C.1.00 molL﹣1
D.3.18 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工产品,在基础化学实验中,有着重要的作用. 实验室用98.0%的密度为1.84g/mL,浓H2SO4来配置100mL 1.00mol/L H2SO4 . 某学生操作步骤如下:
A、计算需量取该种浓硫酸的体积;
B、检查容量瓶是否漏水;
C、量取浓硫酸;
D、将量取的浓硫酸转移进烧杯中,然后沿烧杯壁缓缓将少量水注入烧杯中,并用玻璃棒不断搅拌,再立即将溶解好的稀硫酸转移到容量瓶中;
E、洗涤烧杯和玻璃棒2~3次,并将洗涤液全部转移至容量瓶;
F、将蒸馏水注入容量瓶,至液面接近表现2~3cm时,改用滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻度线相平;盖紧瓶盖,反复颠倒,摇匀溶液;
G、将配好的溶液转移至事先贴好标签的试剂瓶中.
请回答下列问题:
(1)实验过程中需要的主要仪器除烧杯、玻璃棒、胶头滴管外,还有与 .
(2)步骤C中需量取浓硫酸的体积为mL.
(3)上述步骤中有错,正确的操作应是 .
(4)下列操作分别会对溶液浓度造成怎样的影响(填字母:A.偏高,B.偏低,C.无影响,D.无法确定偏高还是偏低) A、用量筒量取一定量液体时,俯视液面读数
B、使用容量瓶配置溶液时,俯视液面定容后所得溶液的浓度
C、没有用蒸馏水洗涤烧杯2~3次即定容
D、容量瓶刚用蒸馏水洗净,没有烘干
E、定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹液面与刻度线相切
F、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设C+CO22CO;△H>0,反应速率为v1;N2+3H22NH3;△H<0,反应速率为v2 , 对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大
B.同时减小
C.v1增大,v2减小
D.v1减小,v2增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com