
| A. | 用蒸馏法从海水中制淡水 | B. | 从铝土矿中制取金属铝 | ||
| C. | 在高温下黏土烧制陶瓷 | D. | 用石油催化裂解制乙烯 |
分析 A.用蒸馏法从海水中制淡水没有新物质生成;
B.从铝土矿中制取金属铝有新物质铝生成;
C.在高温下黏土烧制陶瓷有新物质生成;
D.用石油催化裂解制乙烯有新物质乙烯生成.
解答 解:A.用蒸馏法从海水中制淡水没有新物质生成,属于物理变化,故A正确;
B.从铝土矿中制取金属铝有新物质铝生成,属于化学变化,故B错误;
C.在高温下黏土烧制陶瓷有新物质生成,属于化学变化,故C错误;
D.用石油催化裂解制乙烯有新物质乙烯生成,属于化学变化,故D错误.
故选A.
点评 本考点考查了物理变化和化学变化的区别,基础性比较强,只要抓住关键点:是否有新物质生成,问题就很容易解决.本考点主要出现在选择题和填空题中.


科目:高中化学 来源: 题型:解答题
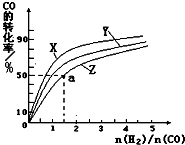 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 中性溶液中:Fe2+、K+、Cl-、${SO}_{4}^{2-}$ | |
| C. | 含有大量Ba2+的溶液中:Mg2+、Na+、${NO}_{3}^{-}$、Cl- | |
| D. | 由水电离出的c(H+)=1×10-12mol-1的溶液中:Na+、Mg2+、HCO3-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mn02是还原剂 | B. | HCl被氧化 | ||
| C. | Mn02发生氧化反应 | D. | 4molHCl参加反应则转移4mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的简单气态氰化物比Y的稳定 | |
| B. | XZ2与QY2中含有j的化学键类型相同 | |
| C. | 元素Q、Y的单质均只存在两种同素异形体 | |
| D. | Y的最高价氧化物对应水化物的酸性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22g由N2O于CO2组成的混合气体中含有的原子数目为1.5NA | |
| B. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| C. | 0.1mol•L-1的AlCl3溶液中含有的Cl-数目为0.3NA | |
| D. | 标准状况下,11.2L水中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com