
分析 (1)IO3-与SO32-反应,IO3-中的碘从+5价降为-1价,SO32-中硫从+4价升为+6价,根据化合价升降配平方程式;
(2)在反应I2+SO32-+H2O═2I-+SO42-+2H+中,当反应达到终点时,碘过量,溶液出现蓝色,据此答题;
(3)根据电子得失守恒有关系式IO3-~3SO32-,25.00mL0.0333mol/L的KIO3溶液中含有KIO3的物质的量为8.325×10-4 mol,根据KIO3的物质的量可计算出样品溶液中亚硫酸钠的浓度;
(4)根据原电池原理,氧化还原反应中还原剂在负极发生氧化反应,氧化剂在正极发生还原反应,据此书写电极反应式;
(5)在CuSO溶液中加入一定量的Na2SO3和NaCl溶液,发生氧化还原反应,铜离子被还原成亚铜离子,生成CuCl沉淀,亚硫酸根被氧化成硫酸根离子,根据电荷守恒和元素守恒书写离子方程式;
(6)加入少量I2时,碘把弱酸(亚硫酸)氧化成强酸(硫酸、氢碘酸),溶液酸性增强,[H+]增大,平衡H2SO3?HSO3-+H+逆向移动,据此判断;
解答 解:(1)IO3-与SO32-反应,IO3-中的碘从+5价降为-1价,SO32-中硫从+4价升为+6价,根据化合价升降配平方程式为IO3-+3SO32-═I-+3SO42-,
故答案为:1、3、1、3;
(2)在反应I2+SO32-+H2O═2I-+SO42-+2H+中,当反应达到终点时,碘反应完全,溶液中蓝色褪去,所以第二种方法达到滴定终点的现象是当滴入最后一滴碘酸钾溶液时,溶液中出现蓝色,且保持30s不变,
故答案为:滴入最后一滴碘酸钾溶液时,溶液中出现蓝色,且保持30s不变;
(3)根据电子得失守恒有关系式IO3-~3SO32-,25.00mL0.0333mol/L的KIO3溶液中含有KIO3的物质的量为8.325×10-4 mol,所以亚硫酸钠的物质的量为2.5×10-3 mol,所以样品溶液中亚硫酸钠的浓度为$\frac{2.5×10{\;}^{-3}mol}{25.00mL}$=0.1mol/L,
故答案为:0.1;
(4)根据反应IO3-+3SO32-═I-+3SO42-,IO3-是氧化剂,SO32-是还原剂,氧化还原反应中还原剂在负极发生氧化反应,氧化剂在正极发生还原反应,所以负极的电极反应式为SO32-+H2O-2e-═SO42-+2H+,正极的电极反应式为IO3-+6H++6e-=I-+3H2O,
故答案为:SO32-+H2O-2e-═SO42-+2H+;IO3-+6H++6e-=I-+3H2O;
(5)在CuSO溶液中加入一定量的Na2SO3和NaCl溶液,发生氧化还原反应,铜离子被还原成亚铜离子,生成CuCl沉淀,亚硫酸根被氧化成硫酸根离子,反应的离子方程式为2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;
(6)加入少量I2时,碘把弱酸(亚硫酸)氧化成强酸(硫酸、氢碘酸),溶液酸性增强,[H+]增大,平衡H2SO3?HSO3-+H+逆向移动,则$\frac{c(H{\;}_{2}SO{\;}_{3})}{c(HSO{\;}_{3}{\;}^{-})}$增大,
故答案为:增大.
点评 本题考查了氧化还原反应、氧化还原滴定、离子方程式的书写、影响 平衡的移动因素等知识,难度中等,综合性较强,答题时注意化学原理的灵活运用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
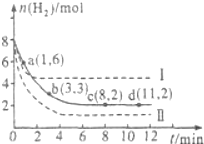 工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
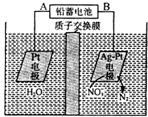
| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池放电时负极质量增加 | |
| C. | 该电解池的阴极反应为:2NO3-+12H++10e-═N2↑十6H2O | |
| D. | 若电路中流过2 mol电子,则阳极室溶液质量减少32g(忽略气体的溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都减小,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1,可知CO的标准燃烧热为:566kJ•mol-1 | |
| B. | 含溶质0.5mol的浓硫酸和含溶质1mol的NaOH的稀溶液完全反应放出的热量为中和热 | |
| C. | 氯化钾中混有少量的硝酸钾,可用溶解、蒸发结晶、趁热过滤的方式来提纯氯化钾 | |
| D. | 淀粉和硫酸的混合溶液加热一段时间后,检验水解液中是否有淀粉时,可取少量水解液于试管中,加入足量的强氧化钠溶液处理,最后滴加少量碘水检验是否有淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | FeCl3 | C. | Na2CO3 | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 铝比铁活泼 | 通常情况下,铝比铁更容易被腐蚀 |
| B | Fe3+具有氧化性 | 铁盐溶液能净水 |
| C | 与水反应时,钠浮在水面上 | 钠与水反应是放热反应 |
| D | Al2O3的熔点高于Al的熔点 | 铝箔被加热到熔化时,也不滴落下来 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com