
| A�� | ת����������̼������Ȼ���Ԫ��ѭ�� | |
| B�� | ת������S��O2���ڲ�ͬ�ĺ��� | |
| C�� | ���ó����ʯ��ˮ����CO2��SO2 | |
| D�� | ת�����Ȼ�ѧ����ʽ�ǣ�2CO��g��+SO2��g���TS��s��+2CO2 ��g����H=+270kJ/mol |
���� A��COȼ�����ɶ�����̼��������̼����Ȼ���пɲ��������ã�
B��S��O2���ڲ�ͬ�ĵ��ʣ�
C��CO2��SO2�������ʯ��ˮ��Ӧ��
D�����ø�˹���ɣ�����-�ڿɵ�2CO��g��+SO2��g���TS��s��+2CO2 ��g���ķ�Ӧ�ȣ�
��� �⣺A��COȼ�����ɶ�����̼��������̼����Ȼ���пɲ��������ã���������̼ѭ������A��ȷ��
B���������ھ���һ������������������ԭ�ӣ���S��O2���ڲ�ͬ�ĵ��ʣ���B����
C��CO2��SO2�������ʯ��ˮ��Ӧ�����ܼ��𣬿����ö�������Ļ�ԭ�ԡ�Ư���Լ��𣬹�C����
D�����ø�˹���ɣ�����-�ڿɵ�2CO��g��+SO2��g���TS��s��+2CO2 ��g����H=-270kJ/mol����D����
��ѡA��
���� ���⿼���Ϊ�ۺϣ��漰��ѧ��Ӧ�����������ʵļ����Լ��Ȼ�ѧ����ʽ��֪ʶ��Ϊ��Ƶ���㣬���ؿ���ѧ���ķ���������ע����ظ���������Լ���˹���ɵ����ã��ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
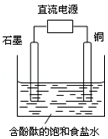 ijС����Ƶ�ⱥ��ʳ��ˮ��װ����ͼ��ͨ��������������ݲ���������������ȷ���ǣ�������
ijС����Ƶ�ⱥ��ʳ��ˮ��װ����ͼ��ͨ��������������ݲ���������������ȷ���ǣ�������| A�� | ͭ�ǵ��ص����� | B�� | ʯī�缫������Һ�ʺ�ɫ | ||
| C�� | ͭ�缫�ϲ���������ɫ���� | D�� | ʯī�缫�Ϸ�����ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ȳ | B�� | ��ϩ | C�� | ����ϩ | D�� | ��Ȳ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| t/s | 0 | 2 | 4 | 6 | 8 |
| n��Z��/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A�� | ��ʹ�ô�������Ӧ���ʺ�X��ת���ʾ����� | |
| B�� | �����������䣬�����¶ȣ��ٴﵽƽ��ʱc��Z��=0.8 mol•L-1�����H��0 | |
| C�� | �����������䣬�������ѹ����1.0 L��ƽ�ⳣ�������� | |
| D�� | �¶Ȳ��䣬���������ٳ���2 mol X��1 mol Y����Ӧ�ﵽ��ƽ��ʱ $\frac{n��Z��}{n��Y��}$ ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ӦC��s��+H2O��g���TCO��g��+H2��g���ġ�H��0����S��0 | |
| B�� | Ǧ�����طŵ�ʱ�������������٣������������� | |
| C�� | ��Na2S��Һ�м�������NaOH�������Һ��c��Na+��/c��S2- ������ | |
| D�� | ��ƽ����ϵCH3COOH+C2H5OH?CH3COOC2H5+H2O�У�������Ũ���ᣬ����ת���ʲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2CH4��g��+4O2��g����2CO2��g��+4H2O��1������H=+890kJ•mol-1 | |
| B�� | CH4��g��+2O2��g����CO2��g��+2H2O��1������H=+445kJ•mol-1 | |
| C�� | CH4��g��+2O2��g����CO2��g��+2H2O��1������H=+890kJ•mol-1 | |
| D�� | $\frac{1}{2}$CH4��g��+O2��g��=$\frac{1}{2}$CO2��g��+H2O��1������H=-445kJ•mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com