
把镁条投入盛有盐酸的烧杯中,产生H2的速率可由下图表示。
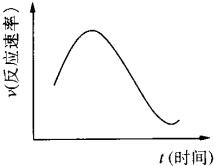
在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度。影响反应速率的因素是
A.①④ B.③④ C.①②③ D.②③
科目:高中化学 来源: 题型:
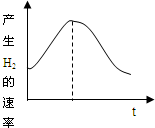 把镁条投入盛有盐酸的敞口容器中,产生氢气速率变化如图所示.下列因素中,影响反应速率的因素是( )
把镁条投入盛有盐酸的敞口容器中,产生氢气速率变化如图所示.下列因素中,影响反应速率的因素是( )查看答案和解析>>
科目:高中化学 来源: 题型:

①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①②③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
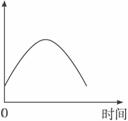
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.②③ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化如下图所示。在下列因素中,影响反应速率的因素是( )
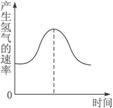
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①②③ D.②③
查看答案和解析>>
科目:高中化学 来源:2010年江西省高二上学期第一次月考(化学) 题型:填空题
(6分)(1)把镁条投入盛有盐酸的敞口容器中,产生氢气速率变化如图所示。
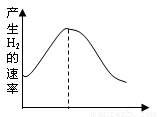
在反应过程中导致速率变化的因素有
①H+的浓度②镁条的表面积③溶液的温度④Cl—的浓度
(2)影响速率的有关因素有:物质本身的性质、浓度、温度、催化剂等方面,依据影响速率的有关因素分析下列问题:
①Mg和Fe均可以与O2反应, Mg在空气中可以点燃, Fe在空气中不能点燃,是由于 的影响;
②Fe在空气中加热不能燃烧,但在纯氧中可以,是由于 的影响;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com