
【题目】下列有关实验原理或实验操作正确的是

A.用装置甲收集SO2并验证其漂白性
B.用装置乙验证氯气与水反应有盐酸生成
C.用澄清石灰水鉴别苏打溶液和小苏打溶液
D.用NaOH溶液除去苯中混有的少量苯酚,反应后分液
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液溶质物质的量浓度为1 mol/L
C.0.5 L 2 molL﹣1的BaCl2溶液中,Ba2+和Cl﹣的总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 gcm﹣3)与10 mL18.4 molL﹣1的硫酸的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石与石墨是碳的两种同素异形体,在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热量,下列说法正确的是( )
①金刚石比石墨稳定
②石墨比金刚石稳定
③1mol石墨比1mol金刚石的总能量高
④1mol石墨比1mol金刚石的总能量低
A.②③B.①③C.②④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对电解原理进行实验探究。

请回答:
用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42—)在溶液中呈紫红色。
(1)电解过程中,X极区溶液的pH________(填“增大”、“减小”或“不变”);
(2)电解过程中,Y极发生的电极反应为Fe-6e—+8OH—═FeO42—+4H2O 和 4OH——4e—═2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一。
(l)三氟化氮可由氨气和氟气反应得到: 4NH3+3F2=NF3+3NH4F。NH3的电子式为__________,反应中氨气显示的化学性质有______________,当有17.0 g氨气发生反应时,转移电子的物质的量为_____。
(2)在潮湿的空气中,NF3能与水蒸气发生反应,产物有HF、NO和一种酸,则被氧化与被还原元素原子的物质的量之比为_________,NF3、F2、NO三种气体氧化性由弱到强的顺序为_________。
(3)三氟化氮在空气中泄露时,很易被发现,依据的现象是______________________。
(4)NCl3结构类似NF3,但NCl3中N元素显-3价,NCl3遇水发生反应,目反应为非氧化还原反应,该反应的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常用于混合物的分离和提纯的装置示意图,请回答: 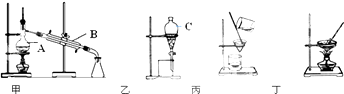
(1)图中仪器A、B、C的名称依次是、、 .
某研究性学习小组设计并进行以下实验从海带中提取碘:![]()
(2)灼烧海带时,除需要泥三角、三脚架、坩埚外,还需要用到的实验仪器是(填字母).
A.烧杯
B.蒸发皿
C.酒精灯
D.坩埚钳
(3)步骤③的操作名称是 , 也可以用汽油做实验,理由是 .
(4)步骤④的目的是从含碘的苯溶液中分离出单质碘,同时回收苯,选择上述装置图(填图的序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、、以及等质量的两片滤纸.
(2)计算.配制该溶液需取NaCl晶体g.
(3)称量.①天平调平之后,应将天平的游码调至某个位置,请在图1中用一根竖线标出游码左边缘所处的位置: 
②称量过程中NaCl晶体应放于天平的(填“左盘”或“右盘”).
③称量完毕,将药品倒入烧杯中.
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用引流,需要洗涤烧杯2~3次是为了 .
(6)定容,摇匀. 将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、、 .
(7)在配制过程中,某学生观察定容时液面情况如图2所示,所配溶液的浓度会(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔质量是指单位物质的量的物质所具有的质量.
(1)已知O的相对原子质量为16,则O3的摩尔质量为 .
(2)48gN2H4的物质的量为 , 所含氢原子数目为 .
(3)标准状况下,相同体积的CH4和SO2气体的质量比为;相同质量的CH4和SO2分子个数比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( )
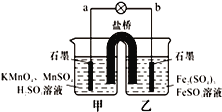
A. 外电路的电流方向是从a到b
B. 甲烧杯中溶液的pH逐渐减小
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. 乙烧杯中发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com