
 )是有机工业的重要原料,可用于合成多种有机物.
)是有机工业的重要原料,可用于合成多种有机物.
 .
. ,合成路线流程图为:
,合成路线流程图为: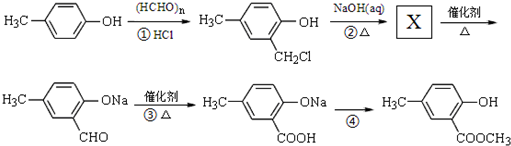
 ;
; 任意一种.
任意一种.分析 Ⅰ.A为对甲基苯酚,C在酸性条件下发生水解反应,-CN转化为-COOH生成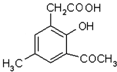 ,一定条件下得到D,结合D的分子式可知,
,一定条件下得到D,结合D的分子式可知, 脱去1分子水生成D,故羧基与酚羟基发生酯化反应;
脱去1分子水生成D,故羧基与酚羟基发生酯化反应;
Ⅱ.(3)反应②发生卤代烃的水解反应、酚羟基与氢氧化钠的反应,生成X为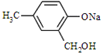 ;
;
(4)检验反应③的产物中残留有机反应物,可以检验是否含有醛基;
(5)G的同分异构体满足:①分子中含有苯环,且苯环上一氯代物只有一种,②能发生水解反应,含有酯基,③遇FeCl3溶液显紫色,含有酚羟基,结合G的结构可知,还含有2个甲基、1个-OOCH,且-OH与-OOCH处于对位位置,2个甲基分别与-OH相邻或与-OOCH相邻.
解答 解:Ⅰ.(1)根据A的结构可知,其名称为对甲基苯酚,故答案为:对甲基苯酚;
(2)C在酸性条件下发生水解反应,-CN转化为-COOH生成 ,一定条件下得到D,结合D的分子式可知,
,一定条件下得到D,结合D的分子式可知, 脱去1分子水生成D,羧基与酚羟基发生酯化反应,故D的结构简式为
脱去1分子水生成D,羧基与酚羟基发生酯化反应,故D的结构简式为 ,故答案为:
,故答案为: ;
;
Ⅱ.(3)反应②发生卤代烃的水解反应、酚羟基与氢氧化钠的反应,生成X为 ,反应方程式为:
,反应方程式为: ,
,
故答案为: ;
;
(4)检验反应③的产物中残留有机反应物,可以检验是否含有醛基,所用试剂为银氨溶液或新制氢氧化铜悬浊液,故答案为:银氨溶液或新制氢氧化铜悬浊液;
(5)G的同分异构体满足:①分子中含有苯环,②能发生水解反应,含有酯基,③遇FeCl3溶液显紫色,含有酚羟基,且苯环上一氯代物只有一种,结合G的结构可知,还含有2个甲基、1个-OOCH,且-OH与-OOCH处于对位位置,2个甲基分别与-OH相邻或与-OOCH相邻,符合条件的同分异构体为: ,故答案为:
,故答案为: 任意一种.
任意一种.
点评 本题考查有机物的推断与合成、官能团的结构与性质、同分异构体书写等,需要学生熟练掌握官能团的性质与转化,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
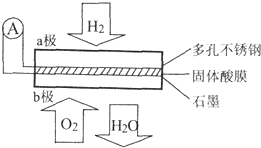 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )| A. | H+由b极通过固体酸电解质传递到a极 | |
| B. | b极上的电极反应式为:O2+4H++4e-=2H2O | |
| C. | 每转移0.4 mol电子,生成3.6g水 | |
| D. | 电池工作时,化学能主要转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O>HF>H2S | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 离子半径:Cl->S2->K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 毒品就是有毒的药品 | |
| B. | 我国明代医学家李时珍所著的医学名著是《本草纲目》 | |
| C. | R表示处方药,OTC表示非处方药 | |
| D. | 麻黄碱是国际奥委会严格禁止使用的兴奋剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | CH3CH2CH2CH2CH3 | C. | 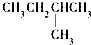 | D. | 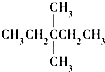 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al<Si | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 酸性:H2SiO3<H2CO3<H3PO4<H2SO4 | D. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出来的c(H+)=1.0×10-12 mol/L | |
| B. | c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | 与同浓度的盐酸分别加水稀释10倍:pH(醋酸)>pH(盐酸) | |
| D. | 在醋酸溶液中加入少量醋酸钠固体,能抑制醋酸的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
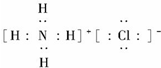 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,可以设计成原电池 | |
| B. | Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率 | |
| C. | 把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化 | |
| D. | Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com