
| A、用NaOH溶液可以除去乙酸乙酯中的乙酸 |
| B、乙烯和苯都能与溴水反应而使溴水褪色 |
| C、用新制的银氨溶液可区分甲酸甲酯和乙醛 |
| D、脂肪、糖类和蛋白质都是人体重要的营养物质 |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
| A、2.0 g重水(D2O)中含有的质子数和中子数都为1.0 NA |
| B、pH>7的溶液中:Na+、K+、CO32-、ClO一、S2-不能大量共存 |
| C、向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动 |
| D、酒精溶于水时没有破坏化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
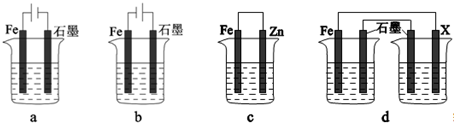
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇和乙酸都能与金属钠反应,也都能发生酯化反应 |
| B、乙烯和苯都能使酸性KMnO4褪色,也都能发生加成反应 |
| C、乙酸和油脂都能与氢氧化钠溶液反应,也都能发生氧化反应 |
| D、淀粉和蛋白质都是天然高分子化合物,也都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
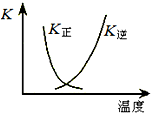 把a molO2和b mol SO2气体充入一密闭容器中,高温条件下发生反应O2+2SO2?2SO3
把a molO2和b mol SO2气体充入一密闭容器中,高温条件下发生反应O2+2SO2?2SO3| X |
| Y |
| 1 |
| 4 |
| X |
| Y |
| 2 |
| 3 |
| X |
| Y |
| 1 |
| 4 |
| X |
| Y |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
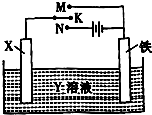 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=+817.63 kJ?mol-1 |
| B、N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ?mol-1 |
| C、N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=+641.63 kJ?mol-1 |
| D、N2H4(g)+2H2O2(l)═N2(g)+4H2O (g)△H=-817.63 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
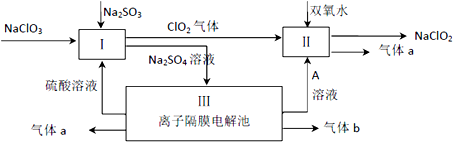
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,22.4L CO2中含有NA个CO2分子 |
| B、17.6g丙烷中所含的极性共价键为4NA个 |
| C、1.7g H2O2中含有的电子数为0.9NA |
| D、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com