
【题目】甲醇燃料电池是目前应用比较广泛的一种燃料电池,其工作原理如下图所示:

下列说法正确的是( )
A.N为正极,发生氧化反应
B.a为氧气,b为甲醇
C.甲池溶液pH增大,乙池溶液pH减小
D.若有1 mol CO2生成,则有6 mol H+从甲池透过交换膜进入乙池
【答案】D
【解析】
根据外电路中的电子的转移方向可知,M极失去电子,为负极,N极得电子,为正极,因甲醇燃料电池中反应物为甲醇和氧气,可判断a为甲醇,b为氧气,则M极的电极反应式为:CH3OH+H2O-6e-=CO2↑+6H+, N极的电极反应式为:O2+4H++4e-=2H2O。
A.N为正极,得电子,发生还原反应,A错误;
B.a为甲醇,b为氧气,B错误;
C.装置中有质子交换膜,可推测电解质溶液为酸溶液,由M极的电极反应式为:CH3OH+H2O-6e-=CO2↑+6H+可知,甲池中消耗水,则酸溶液的浓度增大,pH变小;乙池中消耗H+生成水,酸溶液pH变大,C错误;
D.若有1 mol CO2生成,根据CH3OH+H2O-6e-=CO2↑+6H+可知,电池中转移6mole-,根据![]() O2+6H++6e-=3H2O可知,则有6 mol H+从甲池透过交换膜进入乙池参与反应,D正确;
O2+6H++6e-=3H2O可知,则有6 mol H+从甲池透过交换膜进入乙池参与反应,D正确;
答案选D。


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
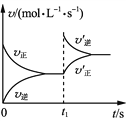
A. t1时刻充入H2,v′正、v′逆变化如右图
B. 第一次达平衡时,H2的体积分数小于20%
C. 温度为T时,起始向原容器中充入0.1 mol铁粉、0.04 mol H2O(g)、0.1 mol Fe3O4(s)、0.005 mol H2(g),反应向正反应方向进行
D. 温度为T时,向恒压容器中加入足量Fe3O4(s)和0.08 mol H2 (g),达平衡时H2(g)转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸和一水合氨是重要的弱酸和弱碱,常温下,其电离常数如下表所示。回答下列问题:
弱电解质 | H2CO3 | NH3·H2O | |
电离常数 |
|
|
|
(1)碳酸的一级电离方程式为______,二级电离常数表达式![]() ________。
________。
(2)浓度均为0.01 mol.L-1的H2CO3溶液和NH3·H2O溶液等体积混合,混合溶液中的溶质是_______(写化学式),混合溶液中![]() 、
、![]() 、
、![]() 、
、![]() 的浓度由大到小的顺序是_______。
的浓度由大到小的顺序是_______。
(3)![]() 和
和![]() 在水溶液中相互促进水解,反应为
在水溶液中相互促进水解,反应为![]() ,则常温下,该反应的平衡常数
,则常温下,该反应的平衡常数![]() _______。(保留2位有效数字)。
_______。(保留2位有效数字)。
(4)室温下,向100 mL 0.2 mol.L-1NaHCO3溶液中加入100 mL 0.2 mol·L-1NH3·H2O溶液,则![]() +____+_____。
+____+_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1LpH=10的NaOH溶液中持续通入CO2。通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示。下列叙述正确的是
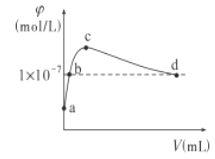
A.a点溶液中:水电离出的c(H+)=1×10-10mol/L
B.b点溶液中:n(Na+)=1×10-10mol
C.c点溶液中:c(Na+)>c(![]() )>c(
)>c(![]() )
)
D.d点溶液中:c(Na+)=2c(![]() )+c(
)+c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
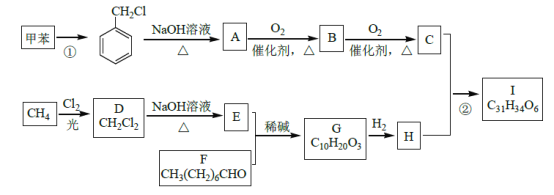
已知:a. 
![]()
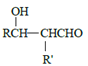
b. 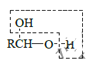
![]() RCHO
RCHO
c.E是甲醛
回答下列问题:
(1)反应①所需试剂、条件分别是____________;F 的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_________________。
(3)G 的结构简式为______________;H 中所含官能团的名称是____________。
(4)化合物W 的相对分子质量比化合物C 大14,且满足下列条件,W的可能结构有__种。其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式____________。
①遇FeCl3溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应
(5)设计用甲苯和乙醛为原料制备 的合成路线,其他无机试剂任选________(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选________(合成路线常用的表示方式为:A![]() B---
B---![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)T1K时,将1mol二甲醚引入一个抽空的150L恒容容器中,发生分解反应:CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由此计算:反应达平衡时,二甲醚的分解率为______,该温度下平衡常数Kc=______。(填数值)
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),在恒温恒容下,若要缩短上述反应达到平衡的时间,可采取的措施有______、______。
(2)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)CH3CHO(g)。反应速率v=v正v逆=k正p(CO)p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,当CO转化率为20%时,![]() =______。
=______。
(3)工业上常用高浓度的K2CO3溶液吸收CO2得到溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
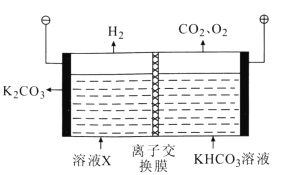
①在阳极区发生的反应包括(电极反应)______和H++![]() =CO2↑+H2O。
=CO2↑+H2O。
②用离子方程式表示![]() 在阴极区再生的过程:______。
在阴极区再生的过程:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,能一步实现下图所示①~⑤转化关系的是

X | Y | Z | W | |
A | C | CO | CO2 | Na2CO3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H+ + OH-正向移动且溶液呈酸性的是( )
H+ + OH-正向移动且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3溶液
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃,使水的pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种浓差电池的装置如图所示,碱液室中加入电石渣浆液[主要成分为Ca(OH)2],酸液室通入CO2(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述错误的是
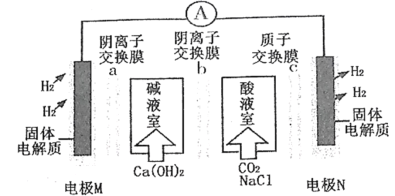
A.电子由电极M经外电路流向电极N
B.在碱液室可以生成NaHCO3、Na2CO3
C.放电一段时间后,酸液室溶液pH减小,碱液室pH增大
D.Cl-通过阴离子交换膜b移向碱液室,H+通过质子交换膜c移向N极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com