
分析 ①用惰性电极电解氯化钠溶液生成氢氧化钠、氢气和氯气;②氯气与水反应生成HCl、HClO;③氯气具有强氧化性,铁在氯气中燃烧生成氯化铁;
解答 解:①电解饱和食盐水生成氢氧化钠和氢气、氯气,电解方程式:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑;②氯气与水反应生成HCl、HClO,化学反应方程式为Cl2+H2O=HCl+HClO,③氯气能将金属氧化为最高价,铁在氯气中燃烧的产物是氯化铁,反应为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:①2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑;②Cl2+H2O=HCl+HClO;③2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
点评 本题考查的是化学方程式的书写知识,属于化学用语的考查,考查学生根据反应原理书写化学方程式的能力,注意化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.题目难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
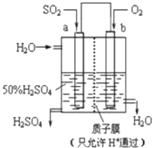
| A. | a为正极,b为负极 | |
| B. | 生产过程中H+向a电极区域运动 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:2H2+SO2-2e-=SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
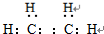 ,B的结构简式
,B的结构简式 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HCl>H2S>H2O | B. | 酸性:HClO4>HNO3>H3PO4 | ||
| C. | 还原性:HCl>HBr>HI | D. | 碱性:NaOH>Mg(OH)2>Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气和氯气反应生成氯化氢气的热化学方程式是H2(g)+Cl2(g)=2HCl(g) | |
| B. | 氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183 kJ•mol-1 | |
| C. | 氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183 kJ•mol-1 | |
| D. | 氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com