
下列各组离子在指定溶液中,可能大量共存的是
①溶有足量氨气的无色溶液中:K+,NH4+,Na+,HSO3-,PO43-,MnO4-
②能使pH试纸变深蓝色的溶液中:K+,Na+,AlO2-,NO3-,S2-,SO32-
③水电离的H+浓度c(H+)=10-13mol/L的溶液中:Cl-,CO32-,SO32-,Fe3+,K+
④加入Al能放出H2的溶液中:Na+,NH4+,K+,SO42-,Cl-,Br-
⑤使石蕊变红的溶液中:Fe3+,Na+,K+,NO3-,SO42-,Cl-
⑥pH=1的溶液中:Fe2+,Al3+,K+,Na+,NO3-,I-,Cl-,S2-
⑦含有大量Fe3+的溶液中:K+,NH4+,Na+,SCN-,I-,Br-
⑧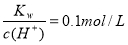 的溶液中:Na+,K+,SO42-,SiO32-,NO3-
的溶液中:Na+,K+,SO42-,SiO32-,NO3-
A.①③④⑥ B.①③⑥⑦ C.②④⑤⑧ D.②⑤⑦⑧
C
【解析】
试题分析:①在无色溶液中紫色的MnO4-不可能存在,而且溶有足量氨气的无色碱性溶液中: HSO3-会发生反应而不能大量存在,错误;②能使pH试纸变深蓝色的溶液是碱性溶液,在碱性溶液中:K+,Na+,AlO2-,NO3-,S2-,SO32-不会发生任何反应,可以大量存在,正确;③水电离的H+浓度c(H+)=10-13mol/L的溶液可能呈酸性也可能呈碱性,在酸性溶液中: CO32-,SO32-会发生反应而不能大量存在,在碱性溶液中Fe3+会方程式沉淀反应而不能大量存在,错误;④加入Al能放出H2的溶液可能呈酸性也可能呈碱性,在酸性溶液中:Na+,NH4+,K+,SO42-,Cl-,Br-不会发生任何反应,可以大量存在;在碱性溶液中NH4+会发生离子反应而不能大量存在,正确;⑤使石蕊变红的溶液是酸性溶液,在该溶液中:Fe3+,Na+,K+,NO3-,SO42-,Cl-不会发生任何反应,可以大量存在,正确;⑥pH=1的溶液是酸性溶液,在该溶液中:Fe2+, NO3-,I-,S2会发生离子反应而不能大量存在,错误;⑦含有大量Fe3+的溶液中:Fe3+与SCN-,I-会发生反应而不能大量存在,错误;⑧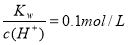 的溶液是碱性溶液,在该溶液中:Na+,K+,SO42-,SiO32-,NO3-不会发生任何反应,可以大量存在,正确。故可能大量共存的是.②④⑤⑧,选项是C。
的溶液是碱性溶液,在该溶液中:Na+,K+,SO42-,SiO32-,NO3-不会发生任何反应,可以大量存在,正确。故可能大量共存的是.②④⑤⑧,选项是C。
考点:考查离子大量共存的知识。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)2.3化学平衡移动试卷(解析版) 题型:选择题
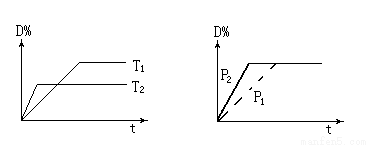
反应2X(g)+Y(g) 2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如下图所示。下列判断正确的是( )
2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如下图所示。下列判断正确的是( )
A.T1<T2,p1<p2B.T1<T2,p1>p2 C.T1>T2,p1>p2D.T1>T2,p1<p2
查看答案和解析>>
科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:选择题
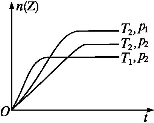
T ℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )
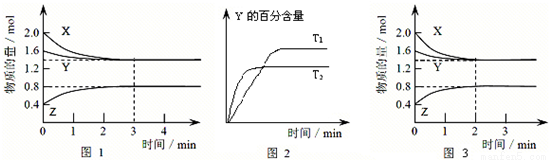
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·L-1·min-1
B.容器中发生的反应可表示为:3X(g)+Y(g) = 2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K增大
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期第一次月考理综试卷(解析版) 题型:选择题
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是

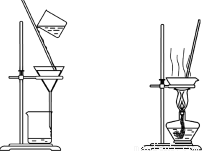
甲 乙 丙 丁
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三入学考试化学试卷(解析版) 题型:填空题
过渡金属催化的新型碳碳偶联反应是近年来有机合成的研究热点之一,如: 
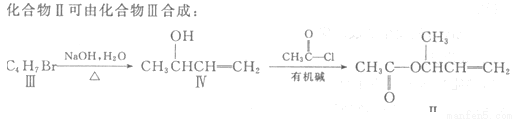
(1)化合物I的分子式为 。
(2)化合物Ⅱ与Br2加成的产物的结构简式为 。
(3)化合物Ⅲ的结构简式为 。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为 因此,在碱性条件下,由Ⅳ与CH3CO--Cl反应合成Ⅱ,其反应类型为 。
(5)Ⅳ的一种同分异构体V能发生银镜反应。V与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为 (写出其中一种)。
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都市高新区高三9月月考化学试卷(解析版) 题型:实验题
(12分)某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如
下几步:
A 移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B 用标准溶液润洗滴定管2-3次
C 把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面刻度
(1) 正确操作的顺序是(用序号字母填写) B- 。
(2) 滴定开始后,眼睛注视 ,判断滴定终点的现象是:
(3) 下列操作中可能使所测盐酸的浓度数值偏高的是
A 碱式滴定管未用标准溶液润洗就直接注入标准液
B 滴定前盛放HCl的锥形瓶用蒸馏水洗净后有少量水残留
C 碱式滴定管在滴定前有气泡,滴定后气泡消失
D 读取氢氧化钠溶液时,开始仰视读数,滴定结束时俯视读数
(4)滴定开始和结束时,碱式滴定管中的液面如图C所示,则终点读数为 mL,所测盐酸溶液的浓度为 mol/L。

查看答案和解析>>
科目:高中化学 来源:2015届四川省成都市高新区高三9月月考化学试卷(解析版) 题型:选择题
可逆反应mA(g)+nB(s) rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分 含量和温度T 或压强P关系如图所示,下列叙述中正确的是
rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分 含量和温度T 或压强P关系如图所示,下列叙述中正确的是
A.温度降低,化学平衡向正反应方向移动
B.使用催化剂,D的物质的量分数增加
C.化学方程式系数m+n = r+q
D.物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都市高新区高三9月月考化学试卷(解析版) 题型:选择题
下列各组变化中,前者是物理变化,后者是化学变化的是
A.煤的气化、煤的干馏
B.用盐酸除金属表面的锈、食盐水导电
C.焰色反应、石油的裂化
D.热的饱和KNO3溶液降温析出晶体、二硫化碳洗涤试管内壁上的硫
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三8月开学测试化学试卷(解析版) 题型:选择题
下列关于乙酸乙酯实验的说法错误的是
A.制乙酸乙酯时,向乙醇中缓慢加入浓硫酸和乙酸
B.可将导管插入饱和碳酸钠溶液中收集反应生成的乙酸乙酯
C.1 mol乙醇与2 mol乙酸在浓硫酸催化作用下不能合成1 mol 乙酸乙酯
D.除去乙酸乙酯中含有的乙酸,最好的处理方法是用足量饱和碳酸钠溶液洗涤后分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com