
下列各溶液中,微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC )+c(H+)>c(C
)+c(H+)>c(C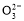 )
)
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S )>c(N
)>c(N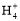 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC )>c(H+)
)>c(H+)
D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题16硫及其化合物练习卷(解析版) 题型:填空题
硫酸和硝酸是中学阶段常见的两种强酸,请就两者与金属铜的反应情况回答下列问题:
(1)在100 mL 18 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 (填写代号);
A.7.32 LB.6.72 LC.20.16 LD.30.24 L
(2)若使上述反应中剩余的铜片继续溶解,可将溶液稀释并向其中加入硝酸钠,写出反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题12钠、铝及其重要化合物练习卷(解析版) 题型:选择题
下列对物质用途的描述中,错误的是( )
A.铝可用于冶炼某些熔点较高的金属
B.Na2O2可用作漂白剂
C.碱石灰可用于干燥CO2、O2等气体
D.NaClO可用作消毒剂
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁—空气燃料电池工作原理示意图。下列有关该电池的说法正确的是( )
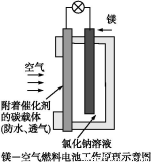
A.该电池Mg作负极,发生还原反应
B.该电池的正极反应式为:O2+2H2O+4e-=4OH-
C.电池工作时,电子通过导线由碳电极流向Mg电极
D.当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:选择题
已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是( )
A.等浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HC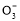 )+2c(C
)+2c(C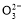 )
)
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷B(解析版) 题型:填空题
某中学课外兴趣小组用惰性电极电解饱和食盐水(含少量Ca2+ 、Mg2+)作系列探究,装置如图所示:
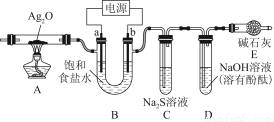
(1)电解时,甲同学发现电极a附近溶液出现浑浊,请用离子方程式表示原因________________________________________________________________________。
(2)一段时间后,你认为C中溶液可能出现的现象是________________________,请用离子方程式表示原因______________________________________。
(3)实验结束后,乙同学将A中的物质冷却后加入到H2S溶液中发现有气泡出现,但加入到稀盐酸中却没有任何现象。请用化学方程式和简要的文字解释原因:________________________________________________________________________________________________________________________________________________。
(4)随着反应的进行,兴趣小组的同学们都特别注意到D中溶液红色逐渐褪去。他们对溶液红色褪去的主要原因提出了如下假设,请你完成假设二。
假设一:B中逸出的气体与水反应生成的物质有强氧化性,使红色逐渐褪去;
假设二:___________________________________________________。
(5)请你设计实验验证上述假设一,写出实验步骤及结论:________________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷B(解析版) 题型:选择题
电化学在日常生活中用途广泛,图①是镁?次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是Cr2O72-的工业废水的处理。下列说法正确的是( )

A.图②中Cr2O72-向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B.图②的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生
C.图①中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
D.若图①中3.6 g镁溶解产生的电量用于图②废水处理,理论可产生10.7 g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:选择题
常温下,将a mol/L的MOH(可溶性弱碱)与b mol/L盐酸等体积混合,已知相同条件下MOH的电离程度大于M+的水解程度,则下列有关推论不正确的是( )
A.若混合后溶液pH=7,则c(M+)=c(Cl-)
B.若b=2a,则c(Cl-)>c(M+)>c(H+)>c(OH-)
C.若a=2b,则c(M+)>c(Cl-)>c(OH-)>c(H+)
D.若混合后溶液满足c(H+)=c(OH-)+c(MOH),则可推出a=b
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:填空题
A、B、C、D、E、F元素是原子序数依次增大的6种短周期元素。已知A是短周期元素中原子半径最小的元素,A和B形成的18电子的化合物X常用作火箭的燃料,C原子最外层电子数与核外电子总数之比为3∶4,E与C同主族,D和C可以形成原子个数比为1∶1和2∶1的两种离子化合物。
据此回答下列问题:
(1)D和C形成1∶1的化合物中阴阳离个数比为____________。
(2)化合物X的结构式为____________。1 mol气态X在适量C2中燃烧,生成B2和气态A2C, 放出534 kJ的热量,1 mol液态A2C完全汽化需吸收44 kJ热量。请写出气态X在C2中燃烧生成B2和液态A2C时的热化学方程式_____________________________________
(3)某化合物由上述6种元素中的3种元素组成,为常见家用消毒剂的主要成分,其中化学键类型为__________________;该化合物水溶液不呈中性的原因是(用离子方程式表示)__________________________________,该化合物可以通过电解D和F形成化合物的水溶液获得,电解时反应的化学方程式为_________________________________
(4)写出一个可以证明C的非金属性大于E的化学反应方程式:_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com