
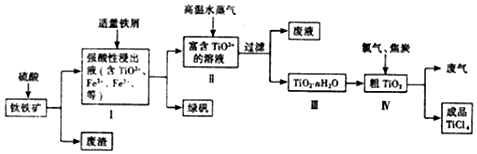
分析 钛铁矿(主要成分是TiO2、少量FeO和Fe2O3)加入硫酸,发生反应H2SO4+TiO2=TiOSO4+H2O,FeO、Fe2O3和硫酸反应生成FeSO4、Fe2(SO4)3,过滤滤液中含有TiO2+、Fe2+、Fe3+,加入适量的铁后将Fe2(SO4)3还原为绿矾,向含有TiO2+、SO42-中不断通入高温水蒸气,维持溶液沸腾一段时间,过滤得到TiO2.nH2O,焙烧得到粗TiO2,通入氯气加入焦炭不反应,生成TiCl4,
(1)硫酸与TiO2反应生成TiOSO4,据此书写;
(2)①根据反应能否自发进行的判据△G=△H-T△S判断;
②根据盖斯定律计算;
(3)氧化还原反应中,氧化剂的氧化性强于还原剂,氧化剂的氧化性强于氧化产物;
(4)TiO2+发生水解反应的化学方程式为TiO2++(n+1)H2O?TiO2•nH2O+2H+,考虑平衡移动;
(5)该工艺流程中产生了废气、废液、废渣,污染环境;
(6)阴极上得电子反应还原反应生成金属钛;阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳.
解答 解:(1)由流程可知,硫酸与TiO2反应生成TiOSO4,离子方程式是TiO2+2H+=TiO2++H2O,故答案为:TiO2+2H+=TiO2++H2O;
(2)①根据反应能否自发进行的判据△H-T△S,△H>0,所以高温下才自发进行,说明该反应的△S>0(或熵增加),故答案为:该反应是熵增反应;
②已知反应:a、TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ•mol-1
b、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ•mol-1
c、C(s)+CO2(g)=2CO(g)?△H3=+282.8kJ•mol-1
根据盖斯定律,反应C(s)+O2(g)=CO2(g)可以看成是a-b-c获得,所以该化学反应的焓变△H=-72kJ•mol-1-282.8kJ•mol-1-38.8kJ•mol-1=-393.6 kJ/mol;
故答案为:-393.6 kJ/mol;
(3)向I(TiO2+、Fe2+、Fe3+)中加入铁屑,有如下反应发生:2Fe3++Fe=3Fe2+,说明氧化性:Fe3+>Fe2+,2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O,则氧化性:TiO2+>Fe2+,Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++4H+,则氧化性:Fe3+>TiO2+,故氧化性为Fe3+>TiO2+>Fe2+;
故答案为:Fe3+;TiO2+;Fe2+;
(4)Ⅱ为富含TiO2+的溶液,有平衡TiO2++(n+1)H2O?TiO2•nH2O+2H+,通入高温水蒸气能降低H+的浓度,提高溶液浓度,促进平衡向水解方向移动,从而析出TiO2•nH2O;
故答案为:通入高温水蒸气能降低H+的浓度,提高溶液浓度,促进平衡向水解方向移动,从而析出TiO2•nH2O;
(5)该工艺流程中产生了废气、废液、废渣,污染环境;
故答案为:产生了废气、废液、废渣;
(6)阴极上得电子反应还原反应生成金属钛,电极反应式为TiO2+4e-=Ti+2O2-,阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳,所以需要定期补充碳;
故答案为:TiO2+4e-=Ti+2O2-;碳单质与阳极产生的氧气反应而不断减少.
点评 本题考查物质的分离提纯和制备,为高频考点,侧重考查学生对化学工艺流程的理解、分析、判断及对知识的综合运用能力,涉及除杂、氧化还原反应、电解原理等知识点,明确化学反应原理、元素化合物性质是解本题关键.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -OH | B. | -COOH | C. | -C 6H 5 | D. | -NH 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的球棍模型: | |
| B. | 硫离子的结构示意图: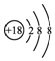 | |
| C. | HF的电子式:H:F | |
| D. | 氯酸钾的电离方程式:KClO3═K++ClO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓HNO3能与碳反应,说明其具有强氧化性 | |
| B. | 浓HNO3能溶解金属铜,说明其具有强酸性 | |
| C. | 浓HNO3不稳定易分解,需要避光保存 | |
| D. | 常温下浓HNO3能使金属铝钝化,可以用铝槽车运输浓HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,C(s)+H2O(g)?CO(g)+H2(g)不能自发进行,则该反应的△H<0 | |
| B. | 合成氨反应中使用高效催化剂可提高原料转化率 | |
| C. | 电解冶炼铝时需定期更换阳极的石墨电极 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 |
查看答案和解析>>
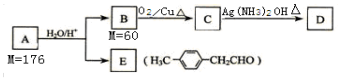
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 30℃甲苯与浓硫酸浓硝酸混合,反应的主要产物为邻硝基甲苯和对硝基甲苯 | |
| C. | 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 | |
| D. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com