
拟用如图所示装置制取下表中四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热,a、b、c、d表示相应仪器中加入的试剂)。
| 气体 | a | b | c | d |
| CO2 | 稀盐酸 | CaCO3 | 饱和NaHCO3溶液 | 浓硫酸 |
| Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 氢氧化钠 |
| NO | 稀硝酸 | 铜屑 | H2O | P2O5 |
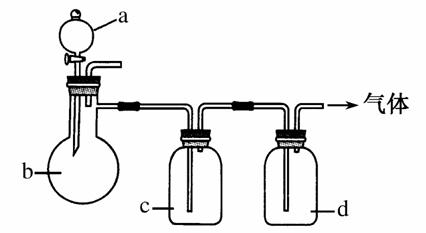
(1)上述方法中可以得到干燥、纯净的________气体。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)。
①气体________,理由:______________________________。
②气体________,理由:______________________________。
③气体________,理由:______________________________。
④气体________,理由:______________________________。
科目:高中化学 来源: 题型:
食盐是一种常用的食品添加剂.新鲜鱼、肉用食盐腌渍后可以延长保存期,是因为( )
|
| A. | NaCl中的Cl﹣有杀菌作用 |
|
| B. | 浓食盐水中含O2少,细菌无法生存 |
|
| C. | 由于食盐使蛋白质变性 |
|
| D. | 由于渗透作用使鱼、肉细胞失水,没有了微生物滋生的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
要检验某溴乙烷中的溴元素,正确的实验方法是( )
|
| A. | 加入溴水振荡,观察水层是否有棕红色出现 |
|
| B. | 滴入AgNO3溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成 |
|
| C. | 加入NaOH溶液共热,然后取上层清夜,加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
|
| D. | 加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应:A2+3B22AB3,以下表示的反应速率中,反应速率最快的是( )
A.v(A2)=0.4 mol·(L·min)-1
B.v(B2)=0.8 mol·(L·min)-1
C.v(AB3)=0.6 mol·(L·min)-1
D.v(A2)=0.01 mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为了探究SO2的漂白作用到底是SO2本身还是SO2与水作用的产物,某学习小组设计了如图装置来进行实验。请回答相关问题。
(1)制备SO2气体的反应方程式为: ;
发生装置的玻璃仪器名为 、 ;
(2)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处。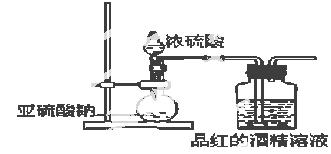
① ;② ;
(3)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是SO2直接导致。为此,SO2能使品红的水溶液褪色的可能微粒有(不考虑水及水电离出来的粒子) 。
(4)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,对此他得出结论:使品红褪色的微粒是HSO3-和SO32-,不是H2SO3。你认为他的结论是否正确 ,其理由是 。
(5)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,再分别一次性加入20ml 0.1mol/L的Na2SO3溶液、20ml 0.1mol/L的NaHSO3溶液,发现加入Na2SO3溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“ ”内容:
| 同浓度溶液 | SO32- | HSO3- | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面_________ | 较上面_______ | 较上面_______ | 慢 |
②根据实验和分析,得出的结论是
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列物质的名称分别是
| 名称 | 硫代硫酸钠 | 多硫化钙 | 过氧化钡 | 超氧化钾 |
| 化学式 | Na2S2O3 | CaSx | BaO2 | KO2 |
根据上述命名规律回答:K2CS3应命名为
A.三硫代碳酸钾 B.多硫碳酸钾 C.过硫碳酸钾 D.超硫碳酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
某硫酸厂以含有SO2的尾气、氨水等为原料,合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
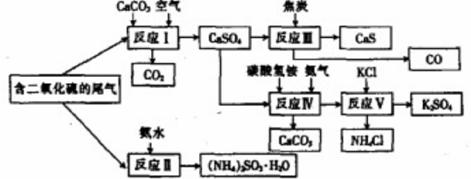
(1)写出反应Ⅲ的化学方程式:
(2)下列有关说法正确的是 (填字母)。
A反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅱ和反应Ⅲ的基本反应类型相同
C.反应Ⅳ需控制在60-70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3) (NH4 )2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式: .
(4)很多硫酸厂为回收利用SO2,直接用氨水吸收法处理尾气.
①用15. 0mL 2.0mol·L-1氨水吸收标准状况下448 mL SO2,吸收液中的溶质为
②某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25. 00 mL,则酸性KMnO4溶液中,c(KMnO4)=
(5)氨气用途广泛,可以直接用于燃料电池,右图是用氨水作燃料的燃料电池的工作原理。

氨气燃料电池的电解质溶液最好选择 (填“酸性”“碱性”或“中性”)溶液,氮气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式
是_______________________________,负极的电极反应式是_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条下,在体积为2 L的密闭容器中,3mol X和3mol Y发生反应:
3X(g)+Y(g)2Z(g),经60 s达到平衡,生成0.4mol Z。下列说法正确的是( )
A.60 s内反应速率为v(X)=0.05mol/(L·s),X的转化率为80%
B.其他条件不变,将容器体积变为4 L,Z的平衡浓度变为原来的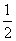
C.其他条件不变,若升高温度,X的体积分数增大,则该反应的ΔH>0
D.其他条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com