
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl3 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -17.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 163 |
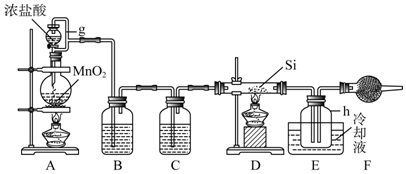
分析 由制备四氯化硅的实验流程可知,A中发生二氧化锰与浓盐酸的反应生成氯气,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,E装置制取氢气,F可防止倒吸,最后氢气还原SiCl4;
(1)装置A是氯气发生装置,A中的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;制备粗硅的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(2)据制得的氯气中含有氯化氢和水,装置B用饱和食盐水除去氯化氢,装置C用浓硫酸吸水;根据产物SiCl4沸点低;为防止SiCl4与空气中的水反应,碱石灰吸收空气中的水;
(3)利用混合物的沸点不同,可用蒸馏的方法分离;
(4)二氧化硅到高纯硅的生产流程中,主要的反应有:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,Si+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4,2H2+SiCl4$\frac{\underline{\;高温\;}}{\;}$Si+4HCl,据此分析.
解答 解:(1)装置A是氯气发生装置,A中的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;制备粗硅的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(2)制得的氯气中含有氯化氢和水,装置B用饱和食盐水除去氯化氢,装置C用浓硫酸吸水;产物SiCl4沸点低,需要冷凝收集;为防止SiCl4与空气中的水反应,碱石灰吸收空气中的水;
故答案为:饱和食盐水;浓硫酸;产物SiCl4沸点低,需要冷凝收集;吸收空气中的水蒸气;
(3)根据图,杂质与四氯化碳的沸点相差较大,利用混合物的沸点不同,可用分馏的方法分离;
故答案为:蒸馏;
(4)二氧化硅到高纯硅的生产流程中,主要的反应有:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,Si+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4,2H2+SiCl4$\frac{\underline{\;高温\;}}{\;}$Si+4HCl,含硅的物质中,作为氧化剂的有SiO2、SiCl4,作为还原剂的有Si;
故答案为:SiO2、SiCl4;Si.
点评 本题考查制备实验方案的设计,综合了氯气的制法、硅的提纯等实验知识,为高频考点,把握制备原理及实验流程中的反应、物质的性质等为解答的关键,题目难度中等.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:多选题
| A. | C2H4和C5H6 | B. | 乙醇和二甲醚 | ||
| C. | 正丁烷和异戊烷 | D. | 一溴乙烷和二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸盐可用于制作光导纤维 | |
| B. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 | |
| C. | 明矾溶于水后会产生Al(OH)3胶体,可作为净水剂 | |
| D. | 液氨挥发时会吸收大量的热,可作为制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48gO3含有的氧原子数为NA | |
| B. | 11.2LSO3中含有的SO3分子数为NA | |
| C. | 1.8g的NH4+离子中含有的电子数为NA | |
| D. | 0.1L2mol/LNaCl溶液中含有Na+个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在. .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com