
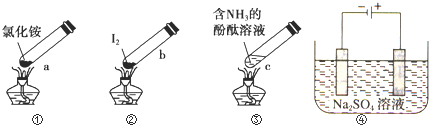
| A�� | ����ʱ��a�ϲ��ۼ��˹���NH4Cl��˵��NH4Cl�����ȶ��ԱȽϺ� | |
| B�� | ����ʱ������b��I2��Ϊ��ɫ���������ϲ��־ۼ�Ϊ�Ϻ�ɫ�Ĺ��� | |
| C�� | ����ʱ��c����Һ��ɫ�����ȴ���ֱ�dz | |
| D�� | �����Ϊe�Ҳ�Ϊf���ڶ��Ե缫e��f�����ֱ�μ���ɫʯ����Һ��e�缫�����ʺ�ɫ��f�缫��������ɫ |
���� A���Ȼ�立ֽ����ɰ������Ȼ��⣬�Ȼ���Ͱ�����Ӧ�������Ȼ�泥�
B�����ȵ����������ϲ���ȴ�����Ĺ��壻
C���¶�����������ܽ�Ƚ��ͣ����ݰ���ʹ��̪����ԭ�����
D����ʯī���缫�����������Һʱ��b�缫��ʧ���ӷ�����ԭ��Ӧ���缫��ӦʽΪ2H2O-4e-=O2��+4H+��a�缫�ϵõ��ӵ缫��ӦʽΪ2H2O+4e-=H2��+2OH-������ʹ��ɫʯ����Һ���ɫ������ʹ��ɫʯ����Һ����ɫ��
��� �⣺A������ʱ�Ȼ�立ֽ����ɰ������Ȼ��⣬���ԹܵĶ����������Ȼ����ַ�Ӧ�����Ȼ�泥�NH4Cl�����ȶ��Խϲ��A����
B�����ȵ���������Ϊ��ɫ���������ϲ���ȴ�ۼ�Ϊ�Ϻ�ɫ�ĵ���壬��B��ȷ��
C����ˮ�Լ��ԣ�ʹ��̪��죬����ʱ�������ݳ�����Һ��ɫ��dz����ȴ����������ˮ��ˮ��Ӧ����Һ��ɫ�ֱ����C����
D��e��f�缫��Ӧʽ�ֱ�Ϊ4H2O+4e-=2H2��+4OH-��2H2O-4e-=O2��+4H+������e�缫������Һ�ʼ��ԡ�f�缫������Һ�����ԣ���e�缫��Һ����ɫ��f�缫��Һ�ʺ�ɫ����D����
��ѡB��
���� �����ԡ����ʵ�顱Ϊ���壬�ۺϿ���Ԫ�ػ����������Լ�����֪ʶ��Ϊ��Ƶ���㣬������ѧ���ķ��������Ŀ��飬�Ѷ��еȣ�ע������Ȼ�淋���������������ע�����֪ʶ���������գ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 35g | B�� | 30g | C�� | 20g | D�� | 15g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
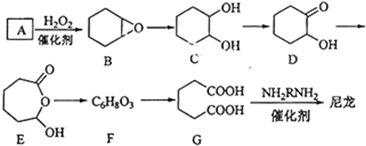
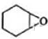 +H2O��
+H2O�� ������ע���������������Լ���ѡ����
������ע���������������Լ���ѡ���� ��
��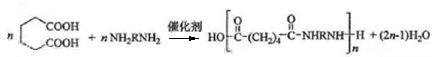 ��
��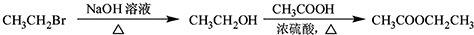
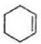 $\stackrel{������Ȼ�̼��Һ}{��}$
$\stackrel{������Ȼ�̼��Һ}{��}$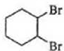 $��_{��}^{��������/��}$
$��_{��}^{��������/��}$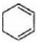 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ԭ��ص��ܷ�ӦΪFe+Cu2+�TFe2++Cu | |
| B�� | ��������KNO3��Һ����������NO3-�������ձ� | |
| C�� | �����������䣬����CuCl2��Һ��ΪNH4Cl��Һ��ʯī�缫��ӦʽΪ2H++2e-�TH2�� | |
| D�� | ��Ӧǰ���缫������ȣ�һ��ʱ������缫�������12g��������ͨ��0.2mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | Na+��Ba2+��NH4+ |
| ������ | CH3COO-��OH-��Cl-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2SO4��aq��+BaCl2��aq���TBaSO4��s��+2HCl��aq����H��0 | |
| B�� | 2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��l����H��0 | |
| C�� | 4Fe��OH��2��s��+2H2O��l��+O2��g���T4Fe��OH��3��s����H��0 | |
| D�� | 3Cu��s��+8HNO3��aq���T3Cu��NO3��2��aq��+2NO��g��+4H2O��l����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
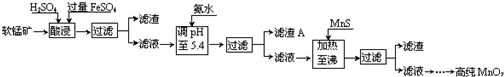
| ������ | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Mn��OH��2 | Cu��OH��2 | Zn��OH��2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ��-0.42 | ��2.5 | ��7 | ��7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | Na2CO3��Һ | B�� | BaCl2��Һ | C�� | NaAlO2��Һ | D�� | Fe��OH��3���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com