
 由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.分析 (1)铁是26号元素,铁原子核外有26个电子,铁原子失去3个电子变为Fe3+,根据构造原理写出Fe3+基态离子核外电子排布式;
(2)根据碳原子成的σ键、孤电子对数目确定杂化轨道数目,进而确定C原子杂化方式;单键都是σ键,双键和三键都是只有一个σ键;
(3)原子数相同,电子总数相同的分子,互称为等电子体,等电子体的结构相似,据此分析;
(4)根据均摊法计算出验原子数目.
解答 解:(1)铁是26号元素,铁原子核外有26个电子,铁原子失去3个电子变为Fe3+,根据构造原理知,该离子核外电子排布式为[Ar]3d5,
故答案为:[Ar]3d5;
(2)HCHO分子,C原子成3个σ键键、没有孤电子对,杂化轨道数目为3,故其杂化类型为sp2杂化;
单键都是σ键,双键和三键都是只有一个σ键,HCN中含有1个H-C键,1个C≡N键,故共有2个σ键,所以1mol HCN中含有的σ键的数目为2mol;
故答案为:sp2;2;
(3)将2个N原子换成CO,所以与N2O互分等电子体的一种分子为CO2,又等电子体的结构相似,所以N2O的空间构型为直线型;将N原子电子数减1得C原子,所以与N2O互分等电子体的一种离子为CNO-,故答案为:直线型;CNO-;
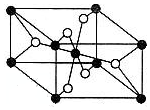
(4)黑球的数目=8×$\frac{1}{8}$+1=2,白球数目=4×$\frac{1}{2}$=4,黑白球比例为1:2,故黑球是Ti,
故答案为:钛(Ti).
点评 本题考查较综合,涉及核外电子排布式的书写、等电子体、杂化轨道类型、σ键数的判断等知识点,题目难度中等.注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 大于0.6mol | B. | 大于零 | C. | 等于1mol | D. | 任意值 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
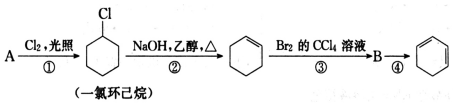
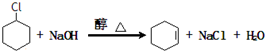 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
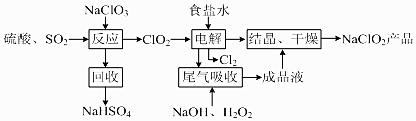
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 23:12:9 | C. | 9:12:23 | D. | 36:69:92 |
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:填空题
2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
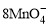 +5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
+5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
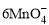 +5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
+5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式
______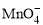 +______Fe2++______H+ =______Mn2++______Fe3++___
+______Fe2++______H+ =______Mn2++______Fe3++___ ___H2O
___H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)混合物中Cu2S的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列说法正确的是
A.(CH3)3CCH2(CH3)C=CH2的名称为:2,2,4-三甲基-4-戊烯
B.碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种(不考虑顺反异构)
C.1mol有机物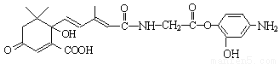 与NaOH溶液反应,最多消耗5molNaOH
与NaOH溶液反应,最多消耗5molNaOH
D.1molβ-紫罗兰酮(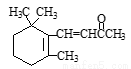 )与1molHBr发生加成反应可得到3种不同产物
)与1molHBr发生加成反应可得到3种不同产物
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列分散系中分散质粒子最小的是
A.葡萄糖溶液 B.Fe(OH)3胶体 C.少量植物油和水混合 D.泥水
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
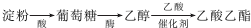
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com