

分析 (1)Fe3+遇KSCN溶液变血红色,据此检验Fe3+;
(2)CuSO4溶液中逐滴加入氨水先生成氢氧化铜,再加过量的氨水氨水与氢氧化铜生成铜氨络离子;
(3)①加热时氨气易挥发,使平衡-[Cu(NH3)4]2+?Cu2++4NH3.向正反应方向移动,且加热时,Cu2+水解程度变大;
②根据题中图2可知,溶液中乙醇含量越高,络氨铜在乙醇-水混合溶剂中的溶解度越小,洗涤时既要能除去固体表面可溶的杂质杂质,又要尽可能减少晶体因溶解而损失,据此选择试剂;
(4)氨含量的测定过程中,根据0.1200mol•L-1的NaOH溶液VL,计算出与之反应的盐酸,再根据盐酸的总量为30.00mL×0.5000mol.L-1=0.015mol可计算得与氨气反应的盐酸,并由此计算出样品中的氨的质量,根据络氨铜样品中氨的质量分数=$\frac{氨的质量}{样品质量}$×100%计算.
解答 解:(1)Fe3+遇KSCN溶液变血红色,所以检验CuSO4溶液中是否含有Fe3+的方法为取适量溶液,滴加KSCN溶液,如果溶液变红,说明含有Fe3+,反之则无,
故答案为:取适量溶液,滴加KSCN溶液,如果溶液变红,说明含有Fe3+,反之则无;
(2)CuSO4溶液中逐滴加入氨水先生成氢氧化铜,再加过量的氨水氨水与氢氧化铜生成铜氨络离子,所以反应现象为随着氨水的滴入,产生蓝色絮状沉淀;氨水过量后,蓝色沉淀又溶解,溶液变深蓝色,
故答案为:随着氨水的滴入,产生蓝色絮状沉淀,氨水过量后,蓝色沉淀又溶解,溶液变深蓝色;
(3)①加热时氨气易挥发,使平衡-[Cu(NH3)4]2+?Cu2++4NH3向正反应方向移动,且加热时,Cu2+水解程度变大,导致晶体中有Cu2(OH)2SO4杂质,
故答案为:加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且Cu2+发生水解;
②根据题中图2可知,溶液中乙醇含量越高,络氨铜在乙醇-水混合溶剂中的溶解度越小,所以要从络氨铜溶液中析出络氨铜晶体,向溶液中加入无水乙醇,洗涤时既要能除去固体表面可溶的杂质杂质,又要尽可能减少晶体因溶解而损失,所以洗涤络氨铜晶体用乙醇和水的混合液,故选C,洗涤时用用胶头滴管吸收少量乙醇溶液滴在固体上至浸没固体,待洗液滤出后,重复2~3次,
故答案为:无水乙醇;C;用胶头滴管吸收少量乙醇溶液滴在固体上至浸没固体,待洗液滤出后,重复2~3次;
(4)0.1200mol•L-1的NaOH溶液VL,可以中和掉的盐酸的物质的量为0.12Vmol,溶液中盐酸的总量为30.00mL×0.5000mol.L-1=0.015mol,所以与氨气反应的盐酸的物质的量为0.015mol-0.12Vmol,所以样品中的氨的质量为(0.015-0.12V)×17g,所以络氨铜样品中氨的质量分数为$\frac{(0.015-0.12V)×17g}{ag}$=$\frac{17(0.015-0.12V)}{a}$,
故答案为:$\frac{17(0.015-0.12V)}{a}$.
点评 本题考查物质的制备,涉及化学平衡移动、结晶方式的分析、化学计算等,弄清实验原理、目的、要求、步骤和注意事项是解题的关键,中等难度.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
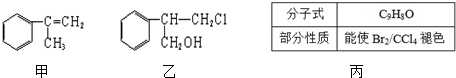
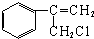 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙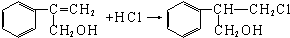 _(不需注明反应条件).
_(不需注明反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸 纯碱 烧碱 | B. | 硝酸 烧碱 氯化钠 | ||
| C. | 醋酸 酒精 碳酸钙 | D. | 盐酸 熟石灰 苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青蒿素 | B. | 青霉素 | C. | 虾青素 | D. | 维生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3{V}_{1}-{V}_{2}}{{V}_{1}+{V}_{2}}$ | |
| B. | $\frac{({V}_{1}+{V}_{2})×1{0}^{-14}}{{V}_{2}-3{V}_{1}}$ | |
| C. | $\frac{({V}_{1}{P}_{1}+{V}_{2}{P}_{2})×1{0}^{-14}}{({V}_{2}-3{V}_{1}){P}_{3}}$ | |
| D. | $\frac{({V}_{1}{P}_{1}+{V}_{2}{P}_{2})×1{0}^{-14}}{(3{V}_{1}-{V}_{2}){P}_{3}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com