
| A、负极Sn-2e→Sn2+ |
| B、正极Fe-2e→Fe2+ |
| C、正极2H2O+O2-2e→4OH- |
| D、负极Fe-2e→Fe2+ |
科目:高中化学 来源: 题型:
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、HClO是弱酸,所以NaClO是弱电解质 |
| C、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D、杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ |
| C、①②③ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
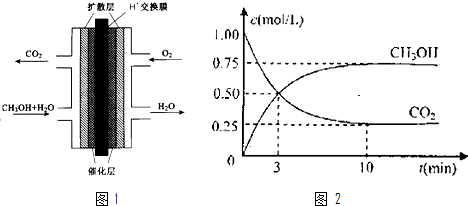
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ?mol-1 |
| B、稀醋酸与0.1 mol?L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1 |
| C、已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ?mol-1 |
| D、已知2C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1,则可知C的燃烧热△H=-110.5 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2CO3?2H++CO32- |
| B、NaHSO4(溶液)=Na++H++SO42- |
| C、NaHCO3=Na++HCO3- |
| D、Ba (OH)2=Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com