
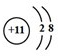
| A. | ${\;}_{53}^{127}$I、${\;}_{53}^{131}$I、${\;}_{55}^{134}$Cs、${\;}_{55}^{137}$Cs是四种核素,两组同位素 | |
| B. | ${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs的中子数分别是78、82 | |
| C. | 在周期表中Cs与I位于同一周期 | |
| D. | 铯与碘能化合生成CsI |
分析 A.元素符号的左上角表示质量数,左下角表示质子数,中子数=质量数-质子数;核素是由质子数和中子数决定;同位素是质子数相同,中子数不同的原子;
B.元素符号的左上角表示质量数,左下角表示质子数,中子数=质量数-质子数来解答;
C.根据碘和铯的质子数确定两元素在周期表中位置;
D.一般来说,活泼金属元素与非金属元素容易形成离子化合物.
解答 解:A.12753I、13153I、13455Cs、13755Cs的质子数分别为53、53、55、55、中子数分别为:74、78、79、82,是四种核素;12753I、13153I的质子数相同、中子数不同,是同位素;13455Cs、13755Cs的质子数相同、中子数不同,是同位素,故A正确;
B.13153I和13755Cs的质子数分别为:53、55,中子数分别为:78、82,故B正确;
C.I的质子数为53,与稀有气体54Xe属于第5周期,Cs位于Xe的下一周期,属于第6周期,故C错误;
D.铯最外层有一个电子,易失去,碘最外层有7个电子,易得一个电子,故铯与碘能化合生成CsI,故D正确;
故选C.
点评 本题主要考查了原子符号的含义、核素的种类以及同位素的概念,化合物的形成,难度不大.


科目:高中化学 来源: 题型:选择题
| 事实 | 推测 | |
| A | ${\;}_{12}^{\;}$Mg与水反应缓慢,${\;}_{20}^{\;}$Ca与水反应较快 | ${\;}_{56}^{\;}$Ba(DA族)与水反应会更快 |
| B | 是半导体材料,同族的Ge也是半导体材料 | Ⅳ族的元素都是半导体材料 |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
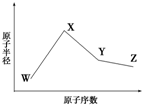 已知W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X、Y、Z同周期,其中X的M层电子数是K层的一半;Y的单质是一种常见的半导体
已知W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X、Y、Z同周期,其中X的M层电子数是K层的一半;Y的单质是一种常见的半导体查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl比H2S稳定 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 离子键的本质是带相反电荷的阴、阳离子的相互吸引 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{c(O{H^-})}}{{c(N{H_3}•{H_2}O)}}$ | B. | $\frac{{c(N{H_3}•{H_2}O)}}{{c(O{H^-})}}$ | ||
| C. | c(H+)和c(OH--)的乘积 | D. | OH-的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 )作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
)作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )| A. | 该动力源的突出优点之一是反应产物对环境无污染 | |
| B. | 液态肼燃烧生成1 mol N2时放出的热量为20.05 kJ | |
| C. | 该反应中肼作氧化剂 | |
| D. | 肼和过氧化氢中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p3 | B. | ls22s22p63s23p1 | C. | 1s22s22p2 | D. | 1s22s22p63s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
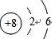 .
.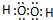 ,化合物XYZ的结构式
,化合物XYZ的结构式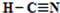 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
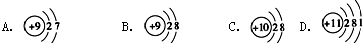
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com