
在溶液中能大量共存的一组离子或分子是
| A.K+ 、Al3+、SO42—、NH3·H2O | B.NH4+、H+、NO3—、HCO3— |
C.Na+ 、CH3COO—、CO32—、OH— | D.Na+、K+、SO32—、Cl2 |
C
解析试题分析:由于一水合氨的碱性比氢氧化铝强,则铝离子与一水合氨容易反应生成氢氧化铝沉淀,故A项错误;由于强酸的酸性比碳酸强,则氢离子与碳酸氢根离子容易反应生成二氧化碳气体和水,故B项错误;Na+ 、CH3COO—、CO32—、OH—之间不能反应,故C项正确;由于氯气具有强氧化性,亚硫酸根离子具有还原性,则氯气与亚硫酸根离子在水中容易发生氧化还原反应,生成硫酸根离子和氯离子,即Cl2+SO32—+H2O=2Cl—+SO42—+2H+,故D项错误。
考点:考查离子或分子共存,涉及元素化合物的主要性质,如铝离子与一水合氨的反应、氢离子与碳酸氢根离子的反应、氯气与亚硫酸根离子的反应等。


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:单选题
下列表示对应化学反应的离子方程式正确的是
| A.用白醋除铁锈:Fe2O3+6H+ = 3H2O + 2Fe3+ |
| B.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热: Ba2+ +2OH-+ NH4+ + HCO3-  NH3↑+2H2O+BaCO3↓ NH3↑+2H2O+BaCO3↓ |
| C.用过量冷氨水吸收SO2: SO2+NH3·H2O=HSO3-+NH4+ |
| D.用强碱吸收工业制取硝酸尾气: NO+NO2+2OH-=2NO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲.乙.丙.丁四种易溶于水的物质,分别由NH4+.Ba2+.Mg2+.H+.OH-.Cl-.HCO3-.SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
| A.甲溶液含有 Ba2+ | B.乙溶液含有SO42- |
| C.丙溶液含有Cl- | D.丁溶液含有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列表示对应化学反应的离子方程式错误的是
| A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+6H+=3I2+3H2O |
| B.向甲酸溶液中加入KOH溶液:HCOOH+OH-=HCOO-+H2O |
| C.将过量CO2通入冷氨水中:CO2+NH3?H2O=HCO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列无色溶液中的离子能大量共存的是
| A.K+、Na+、MnO4-、SO42- | B.H+、K+、NO3-、SO32- |
| C.Na+、Ba2+、Cl-、Br- | D.Fe3+、NH4+、SCN-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在无色的水溶液中能大量共存的一组是( )
| A.Ba2+、AlO2-、OH-、Al3+ |
| B.K+、Fe3+、MnO4-、SCN- |
| C.Mg2+、H+、SO42-、S2O32- |
| D.NH4+、Ca2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列表示对应反应的离子方程式正确的是
A.用惰性电极电解氯化镁溶液:2Cl-+2H+ H2↑+Cl2↑ H2↑+Cl2↑ |
| B.亚硫酸钠溶液中投入Na2O2: SO32-+2Na2O2=SO42-+O2↑+4Na+ |
| C.Fe2O3溶于足量的氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O |
| D.鸡蛋壳和醋酸溶液的主要反应:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学反应的离子方程式正确的是( )
| A.在稀氨水中通入过量CO2:NH3·H2O + CO2 = NH4+ + HCO3- |
| B.少量SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ +2ClO— = CaSO3↓+2HClO |
| C.用稀盐酸与大理石反应:2H+ + CO32— = H2O + CO2↑ |
| D.氢氧化钡溶液与等物质的量的稀硫酸混合:Ba2+ +OH— +H+ + SO42- = BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下: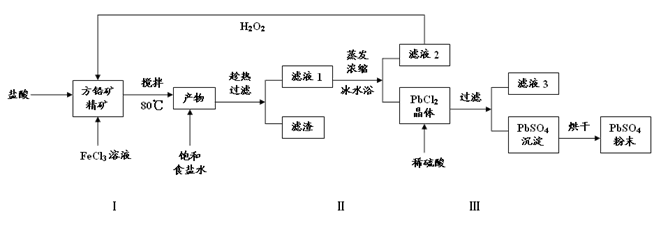
已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl4-(aq) △H>0
PbCl4-(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的 PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com