
(14分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。
Ⅰ.CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1= —574 kJ·mol- 1 .
CH4(g) + 4NO(g) = 2N2(g)+ CO2(g)+2H2O(g) △H2= 一1160 kJ·mol- 1
(1)甲烷直接将NO2还原为N2的热化学方程式为 ;
Ⅱ.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(2)装置Ⅱ中,酸性条件下,NO被Ce 4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO3- 的离子方程式 ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
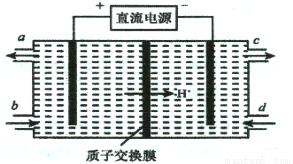
①生成的Ce4+ 从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
(1)CH4(g)+2NO2(g)=2H2O(g)+ CO2(g)+N2(g) △H=-867kJ/mol
(2)NO+2H2O+3Ce4+=3Ce3++NO3-+4H+
(3)①a
②2H++2HSO3-+2e-=S2O42-+2H2O
(4)243a(或5600a/23)
【解析】
试题分析:(1)根据盖斯定律,将两个已知热化学方程式相加得2CH4(g)+4NO2(g)=4H2O(g)+2 CO2(g)+2N2(g) △H=(—574 kJ·mol- 1)+(一1160 kJ·mol- 1)=-1734kJ/mol,所以甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=2H2O(g)+ CO2(g)+N2(g) △H=-867kJ/mol
(2)由图可知,NO被Ce 4+ 氧化为NO3- ,则Ce4+被还原为Ce3+,所以只生成NO3- 的离子方程式为NO+2H2O+3Ce4+=3Ce3++NO3-+4H+
(3)①装置Ⅲ的作用之一是再生Ce4+,在电解池中,阳极上是Ce3+失电子成为Ce4+的过程,所以生成Ce4+从电解槽的阳极上a极流出,
②电解池的阴极发生得电子的还原反应,亚硫酸氢根离子得电子生成S2O42-,电极反应式为2H++2HSO3-+2e-=S2O42-+2H2O
(4)NO2-的浓度为a g?L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子的物质的量是(1000×ag)/46g/mol×(5-3),设需要标准状况下的O2VL,则氧气得电子的物质的量是VL/22.4L/mol×2×(2-0),根据氧化还原反应中得失电子守恒定律,有(1000×ag)/46g/mol×(5-3)= VL/22.4L/mol×2×(2-0),解得V=243aL。
考点:考查盖斯定律的应用,离子方程式的书写,电化学反应原理的应用,氧化还原反应的计算


科目:高中化学 来源:2015届福建省高三上学期半期联考化学试卷(解析版) 题型:选择题
下列实验能达到目的的是
A.将NH4Cl溶液蒸干制备NH4Cl固体
B.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:选择题
右图是研究铁钉腐蚀的装置图,下列说法不正确的是
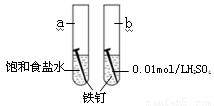
A.铁钉在两处的腐蚀速率:a < b
B.a、b两处铁钉中碳均正极
C.a、b两处铁钉中的铁均失电子被氧化
D.a、b两处的正极反应式均为O2+4e-+4H+ ===2H2O
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三10月月考理综化学试卷(解析版) 题型:填空题
[化学——选修2化学与技术](15分)
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”(侯氏制碱法)两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:_________________________________________________;
②写出“联合制碱法”有关反应的化学方程式_________________ __;
。
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?________________________________________;
(2)钢铁工业对促进经济和社会发展起了重要作用。
① 炼钢时,加入硅、锰和铝的目的是_______________________________。
② 不锈钢含有的Cr元素是在炼钢过程的氧吹__ __(填“前”或“后”)加入。
③ 炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_________。
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三10月月考理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法不正确的是 ( )
A.12.0g熔融的NaHSO4 中含有的阳离子数为0.1NA
B.常温下,5.6gFe投入到足量浓硝酸中,转移电子数为0.3 NA
C.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2 NA
D.足量的锌与一定量的浓硫酸反应生成1 mol气体时,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三上学期第二次检测考试化学试卷(解析版) 题型:选择题
X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略)。下列组合中不符合该关系的是
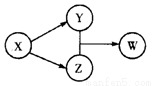
| A | B | C | D |
X | HCl | Na2O2 | Na2CO3 | SO2 |
Y | FeCl2 | NaOH | CO2 | Na2SO3 |
Z | Cl2 | Na2CO3 | CaCO3 | H2SO4 |
W | FeCl3 | NaHCO3 | Ca(HCO3)2 | NaHSO3 |
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三上学期第二次检测考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.若2H2(g)+O2(g) = 2H2O(g) ΔH= -483.6 kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1
B.原子弹爆炸是放热反应
C.若C(石墨,s) = C(金刚石,s) ΔH>0,则石墨能量低且键能小
D.由BaSO4(s) + 4C(s) = 4CO(g) + BaS(s) △H1 = +571.2kJ?mol-1 ①
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) △H2 = +226.2kJ?mol-1 ②
可得反应C(s) + CO2(g) = 2CO(g) 的△H = +172.5kJ?mol-1
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三第一次联考化学试卷(解析版) 题型:填空题
(14分)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
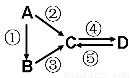
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。写出其 中D与水反应生成的酸名称 。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应 的化学方程式 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反
应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式 。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高一上学期期中考试化学试卷(解析版) 题型:推断题
(13分)有一包白色固体粉末,可能含有CuSO4、Ba(NO3)2、Na2SO4、K2CO3、KCl中的一种或几种,按以下步骤进行实验:
①将该固体粉末溶于足量水中得无色溶液和白色沉淀
②加入足量稀硝酸,沉淀部分溶解并有气体产生
根据以上实验现象推断:
(1)该白色粉末中一定含有 ;一定不含有 ;可能含有 (写化学式)
(2)生成白色沉淀的离子方程式为: 、
(3)沉淀加入稀硝酸反应的离子方程式为:
(4)要确定可能含有的物质,还需要进行的实验操作是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com