
下列说法或做法正确的是( )
A CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性小于碳酸
B 金属钠着火燃烧时,用泡沫灭火器灭火
C 铝比铁活泼,所以铝比铁更容易被腐蚀
D 正常雨水PH等于7,酸雨的PH小于7
科目:高中化学 来源: 题型:
只用哪一种试剂就可将AgNO3、 KSCN、 稀H2SO4 、NaOH 4种无色溶液区分开( )
A.BaCl2溶液 B.FeCl2溶液 C. FeCl3溶液 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)  CO(g)+H2(g); 乙:CO(g)+H2O(g)
CO(g)+H2(g); 乙:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变 ⑦单位时间内,消耗水质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A.①②⑤ B.③④⑥ C.⑥⑦ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
检验SO2中是否混有CO2气体,可采用的方法是( )
A.通过澄清的石灰水 B.通过NaOH溶液,再通过澄清石灰水
C.先通过酸性KMnO4溶液,再通过澄清石灰水
D.先通过NaHCO3溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是:( )
A.金属铝溶于氢氧化钠溶液: 2Al + 6OH- = 2AlO2- + 3H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ═ Al(OH)3↓
C.用FeCl3溶液腐蚀铜电路板: Fe3++ Cu = Fe2++ Cu2+
D.铜片加入浓硝酸中:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成。刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。请写出反应的离子方程式 。
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐(如硫酸铝等),是城市污水及工业废水处理的高效絮凝剂。实验室制取氢氧化铁胶体的方法是 (填字母序号)。
A. 将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可。
B. 在FeCl3溶液中加入足量的NaOH溶液
C. 将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体
D. 将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀
证明此胶体已经制成的最简单方法为 。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下:2FeCl3 + 2KI = 2FeCl2 + I2 +2KI
在上式上用双线桥法标出该反应电子转移的方向和数目。向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为 色,再将混合液倒入 (填仪器名称)中,将两层液体分离。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在固定容积的密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是:
2Z(g)一定达到化学平衡状态的是:
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中气体的压强不再发生变化
④单位时间内生成n mol Z,同时生成n mol X
A.①② B.①④
C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2
(1)属于弱电解质的是 ,溶液呈碱性的有 (填序号)。
(2)常温下0.01 mol/L NaOH溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
mol/L NaOH溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
(3)用离子方程式表示CH3COONa溶液呈碱性的原因 ,其溶液中离子浓度按由大到小的顺序为 。
 (4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
①由图中信息可知HA为_______酸
(填“强”或“弱”)。
②在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”)
③K点对应的溶液中, c(M+)+c(MOH)= mol·L-1。
(5)在25 ℃下,向浓度均为0.01 mol·L-1的FeCl3和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),当测得溶液pH=11时,则此温度下残留在溶液中的c(Cu2+):c(Fe3+)
= 。
(已知25℃时Ksp[Fe(OH)3]=4.0×10-38, Ksp[Cu(OH)2]=2.2×10-20)
(6)25℃时,将bmol NH4NO3溶于水,向该溶液滴加aL氨水后溶液呈中性,则所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb = 2×10-5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
下表列出了某冷轧厂排放的废水中各成份的含量及国家环保标准值的有关数据:
| 冷轧含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg·L-1) | ≤23 000 | ≤150 |
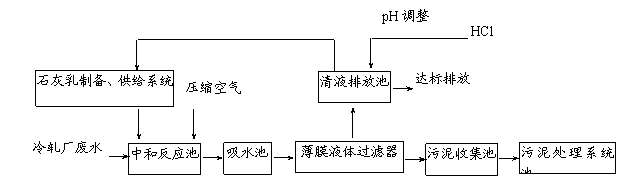 某科研机构为该厂量身定做,设计了如下废水处理系统,不但节约大量工业用水,而且大大降低了生产成本。
某科研机构为该厂量身定做,设计了如下废水处理系统,不但节约大量工业用水,而且大大降低了生产成本。
请回答下列问题:
⑴ 向中和反应池中通入压缩空气的作用是 ▲ 。
⑵ 若废水中细菌含量较高,往往用漂白粉代替石灰乳沉淀Zn2+,漂白粉沉淀Zn2+的离子方程式是
▲ 。
⑶ 污泥处理系统除去污泥后,可得到的工业副产品有 ▲ (填化学式)。
⑷ 薄膜液体过滤器是将膨体聚四氟乙烯专利技术与全自动控制系统完美地结合在一起的固液分离设备。为提高薄膜液体过滤器的过滤能力,废水处理系统工作一段时间后,需要对薄膜进行化学处理,薄膜定期处理的方法是 ▲ 。
⑸ 经上述工艺处理后的废水pH=8,此时废水中Zn2+的浓度为 ▲ mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17), ▲ (填“符合”或“不符合”)国家环保标准。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com