
【题目】现有以下物质:①NaHSO4晶体,②液态O2 ,③冰醋酸(固态醋酸), ④汞,⑤BaSO4固体,⑥Fe(OH)3 胶体,⑦酒精(C2H5OH) ,⑧熔化KNO3,⑨盐酸,⑩金属钠,请回答下列问题(用序号):
(1)以上物质中能导电的是__________
(2)以上物质属于电解质的是_____________
(3)以上物质中属于非电解质的是_______
(4)请写出①在熔融状态下的电离方程式________________
(5)a. 写出制备⑥的实验操作为_________;
b. 制备⑥的离子方程式为____________________,
c. 在制得的⑥中逐滴加入稀硫酸的实验现象为_____________________________。
(6)写出⑩在加热条件下与氧气反应的化学方程式________________________。若将2.3克钠放入97.7克水中,生成的溶液中溶质的质量分数_________(填“大于”、“小于” 或“等于”)2.3%。
(7)标准状况下,CO与CO2相对于②的密度为1,则混合气体中CO与CO2的比例为_________。
【答案】 ④⑥⑧⑨⑩ ①③⑤⑧ ⑦ NaHSO4=Na++HSO4- 向沸水中逐滴加入5-6滴饱和FeCl3溶液, 继续煮沸至溶液呈红褐色,停止加热 Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ 先产生红褐色沉淀后沉淀消失 2Na+O2
Fe(OH)3(胶体)+3H+ 先产生红褐色沉淀后沉淀消失 2Na+O2![]() Na2O2 大于 3:1
Na2O2 大于 3:1
【解析】①NaHSO4晶体在水溶液中能够导电,是电解质;②液态O2为非金属单质,不溶于水,既不是电解质也不是非电解质;③冰醋酸(固态醋酸)在水溶液中能够导电,是电解质, ④汞为金属单质,不溶于水,既不是电解质也不是非电解质;⑤BaSO4固体,不溶于水,在熔融状态下能够导电,是电解质;⑥Fe(OH)3 胶体,是混合物,既不是电解质也不是非电解质;⑦酒精(C2H5OH),在熔融状态和水溶液中都不能导电,是非电解质;⑧熔化KNO3,在熔融状态下能够导电,是电解质;⑨盐酸,是混合物,既不是电解质也不是非电解质;但能导电;⑩金属钠,为金属单质,既不是电解质也不是非电解质;能导电;(1)以上物质中能导电的是 ④⑥⑧⑨⑩;(2)以上物质属于电解质的是 ①③⑤⑧;(3)以上物质中属于非电解质的是⑦; (4)①在熔融状态下,电离成钠和硫酸氢根离子,电离方程式NaHSO4=Na++HSO4-;(5)a. 制备Fe(OH)3胶体的实验操作为:向沸水中逐滴加入5-6滴饱和FeCl3溶液, 继续煮沸至溶液呈红褐色,停止加热;b. 制备Fe(OH)3胶体的离子方程式为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ ;c. 在制得的Fe(OH)3胶体中逐滴加入稀硫酸,硫酸是电解质,先产生胶体聚沉,然后硫酸与氢氧化铁反应而溶解,实验现象为先产生红褐色沉淀后沉淀消失;(6)钠在加热条件下与氧气反应生成过氧化钠,化学方程式2Na+O2
Fe(OH)3(胶体)+3H+ ;c. 在制得的Fe(OH)3胶体中逐滴加入稀硫酸,硫酸是电解质,先产生胶体聚沉,然后硫酸与氢氧化铁反应而溶解,实验现象为先产生红褐色沉淀后沉淀消失;(6)钠在加热条件下与氧气反应生成过氧化钠,化学方程式2Na+O2![]() Na2O2 ;Na与水反应2Na+2H2O═2NaOH+H2↑,m(NaOH)=4g,m(NaOH溶液)=m(Na)+m(H2O)-m(H2)=2.3g+97.7g-m(H2)<100g,所以ω(NaOH)>4%>2.3%,生成的溶液中溶质的质量分数大于2.3%;(7)设CO与CO2的物质的量分别为x、y,标准状况下,CO与CO2相对于O2的密度为1,即
Na2O2 ;Na与水反应2Na+2H2O═2NaOH+H2↑,m(NaOH)=4g,m(NaOH溶液)=m(Na)+m(H2O)-m(H2)=2.3g+97.7g-m(H2)<100g,所以ω(NaOH)>4%>2.3%,生成的溶液中溶质的质量分数大于2.3%;(7)设CO与CO2的物质的量分别为x、y,标准状况下,CO与CO2相对于O2的密度为1,即![]() =32,x:y=3:1,则混合气体中CO与CO2的比例为3:1。
=32,x:y=3:1,则混合气体中CO与CO2的比例为3:1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某物质可能由甲酸、乙酸、甲醇和甲酸乙酯四种物质中的一种或几种物质组成,在进行鉴定实验时记录如下:①有银镜反应②加入新制Cu(OH)2悬浊液不溶解③滴入几滴稀氢氧化钠溶液和酚酞溶液呈红色,加热后变无色。该物质是()
A.一定有甲酸乙酯,可能有甲醇B.四种物质都有
C.有甲酸乙酯和甲醇D.有甲酸乙酯和甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 足量的Fe在1molCl2中充分燃烧,转移3NA个电子
B. 7.8gNa2O2中阴、阳离子总数为0.3NA
C. 电解精炼铜时,若转移NA个电子,则阳极减少的质量为32g
D. 反应KClO3+6HCl═KCl+3Cl2+3H2O中,若有1molH2O生成,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中的有机物可用C6H10O5表示。有关说法正确的是

A. b电极为该电池的负极
B. b电极附近溶液的pH增大.
C. a 电极反应式:C6H1005 -22e- +6H20 =6CO2↑ +22H+
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为有机合成提供了足够的原料——氨。合成氨反应为:N2(g)+3H2(g) ![]() 2NH3(g)。若将标准状况下11.2L的N2与足量的H2进行反应,并将得到的气体通入水中,用1mol/L的硫酸完全中和成正盐,消耗硫酸的体积为200mL。
2NH3(g)。若将标准状况下11.2L的N2与足量的H2进行反应,并将得到的气体通入水中,用1mol/L的硫酸完全中和成正盐,消耗硫酸的体积为200mL。
(1)实验室用98%浓硫酸(密度为1.84g/ml)配制1mol/L的稀硫酸。
①该浓硫酸中H2SO4的物质的量浓度为______________;
②配制时选用的仪器除了量筒、胶头滴管、烧杯外,还需要的仪器有_______________;
③需要量取的浓硫酸的体积为_________。
(2)若消耗1mol/L硫酸的体积小于200mL,则可能的原因是__________
A. 未经冷却就将硫酸转移至容量瓶 B.定容时俯视刻度线
C.往容量瓶转移时,有少量液体溅出 D.定容时仰视刻度线
E.容量瓶未干燥即用来配制溶液
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(3)该反应得到的氨气的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() (主要产物)1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下所示的一系列变化。
(主要产物)1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下所示的一系列变化。
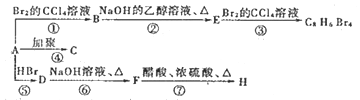
(1)A的化学名称___________,B的分子式为___________。
(2)上述反应中,②是_______反应 (填反应类型) 。
(3)写出E、H物质的结构简式E______,H ________。
(4)出D-F反应的化学方程式 ____________。
(5)写出A—C反应的化学方程式 __________。
(6)满足下列条件的H的同分异构体有________种。(除H外)
①苯环上只有一个支链。②与H宫能团相同且能够水解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中所用仪器合理的是( )
A. 用100mL的量筒量取18.8mLNaOH溶液
B. 用瓷坩埚加热熔融NaOH
C. 用托盘天平称取25.20g氯化钠
D. 用100mL容量瓶配制70mL0.1mol/L盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A. 泡沫灭火器的灭火原理:2A13+ +3 CO32-+3H2O= 2Al(OH)3↓+ 3CO2↑
B. 小苏打溶液呈碱性的原因:HCO3-+H2O![]() H3O++ CO32-
H3O++ CO32-
C. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
D. 向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中物质的量浓度为1mol·L-1的是( )
A. 将20g NaOH固体溶解在500mL水中
B. 将10g NaOH固体溶解在水中配成250mL溶液
C. 将1L 10 mol·L-1的浓盐酸与9L水混合
D. 将标准状况下22.4L HCl气体溶于1L水中配成溶液(已知HCl极易溶于水,0℃时,1体积水能溶解500体积的氯化氢)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com